Vitamina A em teste: a vitamina A causa osteoporose?
Uma das muitas semelhanças que o Dr. Weston A. Price observou entre as dietas das chamadas populações “primitivas” que ele descreveu em Nutrition and Physical Degeneration, às quais atribuiu sua resistência à cárie dentária e sua excelente estrutura esquelética, foi uma riqueza em vitaminas solúveis em gordura, incluindo vitamina A.
Na verdade, o Dr. Price observou que as dietas indígenas eram “pelo menos dez vezes” mais altas em vitaminas solúveis em gordura do que a dieta americana, mesmo supondo que os americanos estivessem cumprindo o regulamento oficial recomendações do dia.
No entanto, nos últimos anos, alguns pesquisadores levantaram a hipótese de que a osteoporose observada entre os idosos nas civilizações modernas, que se manifesta como densidade óssea reduzida e aumento do risco de fratura, 2 é atribuída ao excesso de vitamina A.
A recente conferência Wise Traditions 2005 da Price Foundation ficou surpresa e confusa ao ouvir o Dr. Noel Solomons, diretor da CeSSIAM International Nutrition Foundation, um programa heróico para melhorar a nutrição com vitamina A em países do terceiro mundo, recomendar meras 800 unidades internacionais (IU ) por dia de vitamina A pré-formada de alimentos de origem animal – cientificamente chamada de “retinol” – e avisar que, com base em descobertas recentes do Nurses ‘Health Study, ingestões tão baixas quanto 1.500 UI por dia são prejudiciais à saúde do esqueleto.3
Mais recentemente, o Dr. John Cannel, presidente do Conselho de Vitamina D e também palestrante na conferência da Weston A Price Foundation em 2005, recomendou em um boletim informativo que os suplementos de vitamina D não contêm nenhuma vitamina A pré-formada porque interfere na função da vitamina D , e avisou que “se você apenas tem que tomar” óleo de fígado de bacalhau, “não tome mais do que uma colher de chá por dia.”
O Dr. Cannel sugeriu que o ß-caroteno, um precursor da vitamina A (retinol) encontrado em alimentos vegetais, é uma alternativa segura ao retinol pré-formado encontrado no óleo de fígado de bacalhau.4
Embora a indústria de suplementos vitamínicos afirme que a pesquisa é conflitante e inconclusiva, 5 na verdade, há um corpo impressionante de evidências sugerindo que, em certas circunstâncias, um “excesso” de vitamina A está contribuindo para um risco aumentado de osteoporose em certas populações, mesmo em níveis relativamente baixos.
À primeira vista, a pesquisa parece estar em forte contraste com a observação consistente de Price de níveis muito elevados de vitamina A em dietas nativas que acompanham a saúde esquelética superior desses mesmos grupos.
Uma consideração mais cuidadosa da pesquisa sugere, entretanto, que o que está em questão não é um excesso de vitamina A, mas um desequilíbrio entre a vitamina A e outros nutrientes na dieta, especialmente a vitamina D.
Evidências em humanos e animais sugerem fortemente que a vitamina A só pode causar danos contra o pano de fundo da deficiência de vitamina D, que os níveis suficientes de vitamina A são ainda maiores do que se pensava e que a suplementação com carotenos não é nem adequada nem segura para atingir esses níveis ideais – todos consistentes com e apóia as descobertas atemporais de Price.
Vitamina A, densidade mineral óssea e fratura de quadril: as evidências epidemiológicas
Apenas doze anos depois que a vitamina A foi descoberta como um constituinte do óleo de fígado de bacalhau e da manteiga, uma equipe de pesquisadores liderada por Takahashi estabeleceu em 1925 que ela produzia sintomas tóxicos (agora chamados de “hipervitaminose A”) em ratos quando alimentados como óleo natural de peixe concentrar a 10.000 vezes a quantidade necessária.
Em 1933, esses pesquisadores mostraram que este concentrado rico em vitamina A era tóxico para os ossos em doses extremas, resultando em fraturas espontâneas, e em 1945 Moore e Wang confirmaram que esses efeitos eram atribuíveis à vitamina A induzindo-os com acetato de retinila purificado, que é, como o retinol, um tipo de vitamina A pré-formada.
Os pesquisadores, desde então, relataram lesões esqueléticas em resposta a doses extremas de vitamina A em cães, porcos, coelhos e galinhas. Em humanos, um aumento nos níveis de cálcio no sangue (causado pela lixiviação do cálcio dos ossos), dor nos ossos e outros sintomas relacionados aos ossos às vezes acompanham a hipervitaminose A.6
No entanto, não são doses tão tóxicas e excessivamente excessivas de vitamina A às quais os pesquisadores modernos estão atribuindo a osteoporose, mas a ingestão normal, mesmo relativamente baixa e não tóxica de vitamina A, comum nas sociedades modernas – ingestão muito inferior à dos membros da tribo e aldeões que Weston Price descobriu ter uma saúde esquelética excelente.
Resumo das evidências epidemiológicas
Em 1998, um grupo de pesquisadores suecos liderado por Hakan Melhus observou que as taxas de fratura de quadril variam sete vezes na Europa e são mais altas no norte da Europa, Suécia e Noruega – onde as latitudes do norte impedem a síntese induzida por UV de vitamina D na pele humana durante grande parte do ano, e onde a ingestão de vitamina D está frequentemente bem abaixo dos mínimos recomendados, 6 que eles não perceberam – e onde a ingestão de retinol pré-formado é seis vezes maior do que em qualquer outro lugar na Europa, o que eles notaram devidamente.
O grupo estudou mulheres de Uppsala, um condado da Suécia, e publicou o primeiro estudo sobre a ingestão de vitamina A, densidade mineral óssea (DMO) e risco de fratura de quadril que distinguia entre retinol pré-formado, encontrado em alimentos de origem animal, e seus precursores, os carotenos. em alimentos vegetais.
Eles descobriram que, em comparação com uma ingestão de retinol abaixo de 1.700 UI por dia, a ingestão de retinol superior a 5.000 UI por dia estava associada a uma diminuição de 6% na DMO corporal total, uma diminuição de 10% na DMO no local do quadril, e uma duplicação do risco de fratura de quadril.
Vários grupos de pesquisadores publicaram estudos conflitantes desde 1998, usando diferentes métodos de estimativa da ingestão de vitamina A. Entre eles:
- Ballew e outros publicaram um estudo em 2001 que não encontrou nenhuma relação entre os níveis de vitamina A no sangue e a densidade mineral óssea em americanos no Terceiro National Health and Nutrition Examination Survey (NHANES-III) .8
- Em 2002, Feskanich e outros publicaram descobertas entre enfermeiras americanas que participaram do Nurses ‘Health Study, mostrando que a ingestão de retinol pré-formado, mas não de carotenos, estava associada ao risco de fratura de quadril entre mulheres pós-menopáusicas que não faziam terapia de reposição hormonal ( HRT). Uma ingestão acima de 1.700 UI por dia foi associada a um aumento um pouco inconsistente do risco de fratura, enquanto uma ingestão acima de 6.700 UI por dia foi associada a um risco aumentado de fratura muito mais acentuado e consistente.9
- No mesmo ano, Promislow e outros relataram uma curva em forma de U entre a ingestão de retinol e DMO entre mulheres e homens idosos do sul da Califórnia no estudo Rancho Bernardo, em que uma ingestão ideal de retinol pré-formado no valor de 2.000-2800 UI por dia foi associada a a maior DMO, enquanto um aumento ou diminuição dessa quantidade foi associada a uma menor DMO. A tendência foi mais consistente e mais forte entre as mulheres na pós-menopausa e menos pronunciada entre os homens.10
- Em 2003, um estudo de Michaelsson, Melhus e outros encontrou uma curva em forma de U semelhante para os níveis de vitamina A no sangue e o risco de fratura em homens idosos de Uppsala, Suécia. Em comparação com o quintil do meio, o quintil mais alto de níveis de retinol teve um risco 64 por cento aumentado de qualquer fratura e um risco aumentado de 147 por cento de fratura de quadril. Em comparação com o mesmo quintil médio, os homens com níveis de retinol acima de 3,5 micromoles por litro (µM, que é uma medida de um número específico de moléculas de vitamina A por litro de sangue) tiveram sete vezes mais fraturas. Os pesquisadores concluíram que o risco está principalmente associado a níveis acima de 3 µM. Embora em menor grau, o risco de fratura também aumentou nos quintis mais baixos do retinol sérico.11
- Em 2004, uma equipe liderada por Opotowsky publicou um estudo com mulheres americanas que estabeleceu uma curva em forma de U muito mais limpa, associando os níveis de vitamina A no sangue ao risco de fratura de quadril do que a curva estabelecida pela equipe de Michaelsson. O quintil médio, que agrupou aqueles com níveis sanguíneos de vitamina A entre 1,9 e 2,13 µM, apresentou o menor risco de fratura. Em comparação com este quintil, os quintis mais baixo e mais alto carregam aproximadamente o dobro do risco de fratura.12
- No mesmo ano, Lim e outros publicaram um estudo elaborado a partir de dados representando mais de 41.000 mulheres na pós-menopausa do Iowa Women’s Health Study, que não encontrou nenhuma associação entre a ingestão alimentar de retinol pré-formado e o risco de fratura de quadril. Aqueles que usaram suplementos de vitamina A, como um grupo, tiveram um risco 17 por cento maior de fratura de quadril em comparação com aqueles que não o fizeram, mas não houve relação entre a quantidade de vitamina A ingerida e o risco de fratura de quadril.13
- Barker e outros publicaram um estudo em 2005, este também não conseguindo encontrar uma associação positiva entre a vitamina A e o risco de fratura. Neste estudo, os pesquisadores mediram os níveis de vitamina A no sangue entre mulheres britânicas com mais de 75 anos. Nos quatro anos seguintes, os pesquisadores descobriram uma redução de 15% no risco de fratura osteoporótica entre o quintil mais alto de níveis de vitamina A. Cerca de 40 por cento dos indivíduos estavam usando óleo de fígado de bacalhau ou um multivitamínico, mas nenhuma informação foi fornecida para diferenciar os dois. Este foi o primeiro desses estudos a mencionar o óleo de fígado de bacalhau especificamente como uma fonte de suplementação de vitamina A.14
Estudos mais fortes mostram uma associação
Embora aqueles de nós que gostariam de se sentir seguros sobre a segurança e os benefícios de uma alta ingestão de vitamina A sem dar uma reflexão cuidadosa sobre o assunto, possamos ficar tentados a rejeitar esta pesquisa como conflitante e, portanto, inconclusiva, estudos que não encontraram uma associação entre a vitamina A e DMO ou risco de fratura geralmente sofrem de alguma inadequação, sendo superados por seus homólogos que encontram uma associação.
Por exemplo, o estudo Ballew analisou os dados de forma a revelar uma relação linear entre os níveis sanguíneos de vitamina A e DMO, onde um aumento de um nível de vitamina A para outro resultaria consistentemente em uma diminuição da DMO.
No entanto, ele não procurou uma curva em forma de U, onde tanto uma diminuição quanto um aumento de um nível ideal de vitamina A poderiam reduzir a DMO.8
Quando a equipe de Opotowski analisou seus dados da mesma maneira, encontrou um risco relativo de 1,0 para os níveis de vitamina A no sangue, o que significa que o risco de fratura parece ser distribuído de maneira perfeitamente uniforme entre todos os níveis de vitamina A, sem apresentar relação.
No entanto, quando a equipe de Opotowski analisou os mesmos dados em busca de uma curva em forma de U, descobriu que níveis altos e baixos de vitamina A no soro carregavam o dobro do risco de fratura e níveis ideais – algo que a equipe de Ballew não poderia ter encontrado por causa a forma como o grupo analisou os dados.12
Embora a equipe de Lim não tenha encontrado nenhuma relação entre a ingestão alimentar de retinol pré-formado e o risco de fratura, ela usou apenas um questionário de frequência alimentar de uma semana (FFQ), 13 enquanto o estudo Melhus de 1998 usou quatro FFQs de uma semana 7 e o Nurses ‘Health O estudo usou cinco QFAs de uma semana.
Na verdade, quando o grupo Feskanich analisou o Nurses ‘Health Study usando apenas os dados do primeiro QFA, a associação entre o quinto e o primeiro quintis de ingestão de retinol caiu de estatisticamente significativo (significando consistente e improvável de ser devido ao acaso) 89 risco aumentado por cento para um não estatisticamente significativo (significando inconsistente, com uma alta probabilidade de ser devido ao acaso) risco aumentado de 17 por cento.9
Isso sugere que um FFQ de uma semana não mede a ingestão de retinol com precisão suficiente para detectar uma associação, e que, se os dados de ingestão tivessem estimado com mais precisão a ingestão real de retinol, a equipe de Lim poderia ter encontrado tal associação.
Sintético versus natural: isso importa?
Até agora, as coisas parecem sombrias para a vitamina A. Para aqueles de nós familiarizados com as descobertas há muito estabelecidas do Dr. Price, que associam dietas muito ricas em vitamina A com uma saúde esquelética vibrante, a pesquisa moderna que mostra quantidades muito menores de vitamina A contribuir para a osteoporose pinta um quadro da vitamina A que parece não apenas sombrio, mas também confuso.
Muitos de nós podemos ficar tentados a argumentar que não é um alimento natural rico em vitamina A que contribui para a osteoporose, mas os preparados sintéticos de vitamina A encontrados em multivitaminas e usados para fortificar alimentos como cereais matinais, margarina e leite desnatado.
No entanto, sob um exame mais minucioso, essa arma intelectual familiar em nosso arsenal se mostra impotente, e a resposta deve estar em outro lugar.
À primeira vista, duas evidências parecem sugerir que a vitamina A sintética é exclusivamente a culpada.
Na verdade, 94 por cento da variação na ingestão de retinol entre os quintis mais altos e mais baixos no Nurses ‘Health Study foi atribuída ao retinol suplementar, enquanto apenas 6 por cento da variância entre esses quintis foi atribuída ao retinol alimentar.9
Aparentemente ainda mais poderoso, o estudo do Rancho Bernardo descobriu que aqueles que tomavam suplementos de vitamina A tiveram uma diminuição dependente da dose na densidade mineral óssea (DMO) à medida que consumiam mais retinol, enquanto aqueles que obtinham retinol apenas com alimentos tinham um aumento dependente da dose na DMO enquanto consumiam mais retinol.10
Um exame mais detalhado mostra, como os pesquisadores observaram, que a aparente diferença entre usuários e não usuários de suplementos no estudo do Rancho Bernardo é uma ilusão criada pela diferença na ingestão total de vitamina A entre os dois grupos.
Aqueles que obtiveram seu retinol apenas com alimentos tiveram baixa ingestão de retinol, enquanto aqueles que obtiveram seu retinol de suplementos e alimentos juntos tiveram alta ingestão de retinol, com apenas uma pequena porção de sobreposição entre as ingestões dos dois grupos.10
Figura 1
Reproduzido de J Bone Miner Res 2002; 17: 1349-1358 com permissão da American Society for Bone and Mineral Research.
As linhas pontuadas por quadrados (à esquerda) representam indivíduos que obtiveram retinol apenas de alimentos; as linhas sólidas (direita) representam indivíduos que obtiveram retinol de alimentos e suplementos; as curvas pontilhadas representam os dois combinados.
À medida que uma linha se move para cima, a densidade mineral óssea aumenta. Conforme uma linha se move para a direita, aumenta a ingestão de retinol.
O “X” onde as duas linhas se cruzam representa os pontos nos quais os dois grupos estavam consumindo a mesma quantidade de retinol.
Mesmo quando consumindo as mesmas quantidades de retinol, a densidade mineral óssea aumenta com o aumento da ingestão de retinol para aqueles que não tomam suplementos e diminui com o aumento da ingestão de retinol para aqueles que tomam suplementos.
No entanto, se alguém imaginar a linha pontuada quadrada deslocada para a esquerda para contabilizar o retinol suplementar sendo utilizado em uma taxa mais alta, uma curva em forma de U surge para todas as ingestões de retinol.
Ainda resta um quebra-cabeça: no gráfico da Figura 1, a linha à esquerda, que representa a DMO dos indivíduos que obtiveram retinol apenas com alimentos, cruza a linha da direita, que representa aqueles que obtiveram retinol a partir de suplementos, mas mesmo neste sobreposição, o retinol alimentar permanece protetor, enquanto o retinol suplementar permanece destrutivo – algo que os pesquisadores não explicaram.
A resposta provavelmente é encontrada no fato de que o retinol solúvel em gordura encontrado nos alimentos e algumas formas de suplementos resulta em valores plasmáticos de pico mais baixos (níveis no sangue), reservas de fígado mais baixas e perda fecal mais alta do que o solúvel em água, emulsificado, e formas solidificadas de vitamina A encontradas na maioria dos suplementos.15
Além disso, embora o tipo de vitamina A encontrado nos suplementos, o retinol totalmente trans, seja o tipo mais comum encontrado nos alimentos, os alimentos também contêm uma variedade de outras formas de vitamina A, todos os quais têm níveis mais baixos de atividade do que o retinol totalmente trans.16
Em outras palavras, uma determinada quantidade de retinol dos alimentos é efetivamente uma dose menor de retinol do que a mesma quantidade da maioria das formas de suplementos.
Se imaginarmos que a linha à esquerda na Figura 1 seja deslocada para a esquerda para compensar essa diferença de disponibilidade, a imagem que surge, então, é uma curva em forma de U limpa semelhante à encontrada pela equipe de Opotowsky com níveis de vitamina no sangue A.
A implicação desse fato importante é que maiores quantidades de vitamina A natural terão o mesmo efeito na densidade mineral óssea que menores quantidades de vitamina A suplementar.
Os resultados do Nurses ’Health Study são particularmente condenáveis à ideia de que é sintética, mas não natural, a vitamina A que contribui para a osteoporose.
O grupo de Feskanich relatou a proporção de várias fontes dietéticas de vitamina A neste estudo em grande detalhe e diferenciou entre retinol suplementar e alimentar com rigor impressionante.
Quando os números foram ajustados apenas para a idade, a maior ingestão de retinol de alimentos e suplementos combinados carregou um risco 27% maior em relação ao quintil mais baixo de ingestão.
Os pesquisadores realizaram uma segunda análise que excluiu todas as pessoas que consumiram qualquer forma de vitamina A suplementar.
Para aqueles que obtiveram retinol apenas dos alimentos, o quintil mais alto de ingestão apresentou um aumento de 67% no risco! 9
Os pesquisadores então realizaram uma análise multivariada, que ajustou para ingestão de vitaminas D e K, proteína, cálcio, álcool e cafeína, bem como tabagismo, uso de certos medicamentos e terapia de reposição hormonal, índice de massa corporal e outros fatores além de era.
Nesta análise, a ingestão de retinol de alimentos e suplementos combinados gerou um risco 89 por cento aumentado entre o quintil mais alto de ingestão em comparação com o mais baixo, enquanto aqueles que obtiveram retinol apenas de alimentos tiveram um risco um pouco menor de 67 por cento aumentado no quintil mais alto em comparação com o mais baixo.
Os autores observaram devidamente que mesmo aqueles que não usavam vitamina A suplementar obtinham vitamina A de alimentos fortificados além da vitamina A natural, e realizaram uma terceira análise por esse motivo: aqueles que consumiram fígado pelo menos uma vez por semana tiveram um aumento de 69 por cento risco de fratura em comparação com aqueles que nunca comeram fígado.9
Embora haja uma variedade de razões para obter vitamina A de alimentos em vez de suplementos, evitar os riscos da chamada ingestão “excessiva” de vitamina A com relação à osteoporose não é uma delas.
A pesquisa sugere claramente que a quantidade de vitamina A é o fator operativo, e não a forma da vitamina A.
Nesse ponto, as evidências contra a vitamina A parecem ser inescapavelmente incriminadoras. Há, no entanto, muito mais nesta história.
Vitamina D: o elo perdido
A maioria dos estudos que investigam a ligação entre a vitamina A e a osteoporose vê o “excesso” de vitamina A no vácuo, como se o único fator que determina o que constitui um excesso de vitamina A para um determinado peso corporal seja a própria quantidade de vitamina A.
Na verdade, a toxicidade das vitaminas em geral é freqüentemente determinada pelo uso de grandes doses de uma única vitamina.
Isso pode nos ajudar a atribuir efeitos tóxicos a uma vitamina em particular, mas também impede nossa compreensão de quais efeitos são decorrentes da quantidade absoluta dessa vitamina e quais efeitos se devem a um desequilíbrio entre essa vitamina e outras vitaminas.
A vitamina D protege contra a toxicidade da vitamina A
Pesquisas que examinam a alimentação com altas doses de mais de uma vitamina simultaneamente revelam que a toxicidade depende de reações entre diferentes nutrientes.
Por exemplo, estudos em ratos, perus e galinhas demonstraram que a vitamina A diminui a toxicidade e aumenta a necessidade alimentar de vitamina D, enquanto a vitamina D reduz a toxicidade e aumenta a necessidade alimentar de vitamina A.6
Em 2003, Myhre e outros pesquisadores examinaram todos os 291 casos de hipervitaminose A em humanos relatados na literatura médica entre 1944 e 2000.
Destes, a equipe de Myhre identificou 81 relatórios que forneciam informações sobre a suplementação de vitamina D do paciente e descobriram que a suplementação concomitante com vitamina D aumentou radicalmente a dose de vitamina A necessária para causar toxicidade.
Infelizmente, os pesquisadores apenas mencionaram se a vitamina D foi suplementada e não discutiram a quantidade específica de vitamina D sendo suplementada.
No entanto, eles descobriram que a dose média relatada para a toxicidade da vitamina A era mais de 2.300 UI por quilograma (kg) de peso corporal por dia maior quando a vitamina D também era suplementada. Para uma pessoa hipotética de 75 kg representando a mediana, a suplementação de vitamina D teria permitido um adicional de 175.000 UI por dia (a quantidade em cinco colheres de sopa de óleo de fígado de bacalhau com alto teor de vitaminas) antes que os sintomas de toxicidade fossem relatados! 15
Requisitos de vitamina D no inverno de vitamina D
É difícil resistir à observação de que os países escandinavos, que têm as maiores taxas de fratura na Europa, não só têm maior ingestão média de retinol, mas também existem em latitudes distantes do norte, onde “invernos de vitamina D” – períodos de tempo durante os quais a vitamina D não podem ser produzidos pela ação da luz solar sobre a pele – são mais longos e menos vitamina D está disponível do sol nos meses em que está disponível.
A forma ideal de obter vitamina D é pela exposição ao sol. A luz do sol no espectro ultravioleta-B (UV-B) atinge a pele, convertendo um precursor do colesterol chamado 7-desidrocolesterol em vitamina D3, também chamada de colecalciferol, bem como uma variedade de produtos químicos semelhantes, incluindo a forma ativada da vitamina D , calcitriol.
Quando as condições atmosféricas são ideais e o céu está limpo, 30 minutos de exposição de todo o corpo da pele pálida à luz do sol, sem roupas ou protetor solar, pode resultar na síntese de entre 10.000 e 20.000 UI de vitamina D.
Essas quantidades de vitamina D são grandes, e portanto, capaz de suprir todas as necessidades do corpo.
Ao mesmo tempo, o corpo tem dois mecanismos para evitar o desenvolvimento de um excesso de vitamina D: primeiro, a irradiação adicional converte o excesso de vitamina D na pele em uma variedade de metabólitos inativos; segundo, o pigmento melanina começa a se acumular nos tecidos da pele após a primeira exposição da estação, o que diminui a produção de vitamina D.17
A disponibilidade de raios UV-B, no entanto, depende do ângulo em que a luz do sol atinge a terra, tornando a síntese da vitamina D impossível para a maioria das pessoas na maioria das latitudes durante partes do ano chamadas de “inverno da vitamina D. ”
Fora do inverno da vitamina D, os raios UV-B suficientes para a síntese total da vitamina D não ficam disponíveis repentinamente: a janela de tempo durante cada dia em que a síntese da vitamina D pode ocorrer se expande gradualmente conforme a estação avança, assim como a quantidade de UV- Radiação B disponível dentro da janela.
Em 1988, Webb e outros pesquisadores investigam que algum grau de inverno de vitamina D ocorre acima de 34 graus de latitude, e que em Boston, a 42,2 graus ao norte, o inverno de vitamina D se estende por quatro meses de novembro a fevereiro, enquanto em Edmonton a 52 graus ao norte, estende-se por seis meses, de outubro a março.18
Em 2005, Engelsen e colegas publicaram um estudo que precisa que a equipe de Webb pode ter superestimado o verdadeiro inverno da vitamina D para o céu claro em Boston, provavelmente por confundir nuvens espalhadas, que quase sempre estão presentes mesmo quando o céu parece claro, com presença de nuvens.
Usando um modelo mais preciso, a equipe de Engelsen considera os seguintes fatores: variações naturais na densidade da camada de ozônio podem fazer com que a duração do inverno de vitamina D aumente ou diminua em até dois meses; como nuvens podem eliminar até 99% da radiação UV-B; aerossóis e a presença de edifícios diminuem a exposição aos UV-B; finalmente, o aumento da altitude e as superfícies reflexivas, como a neve, aumentam a exposição aos raios UV-B.
Embora a equipe de Engelsen tenha descoberto que o inverno de vitamina D seria mais curto do que o estimado pela equipe de Webb sob um céu desencadeado “claro”, ela também decorrentes que os fatores desencadeados acima estender o inverno de vitamina D de forma tão dramática que tal inverno às vezes pode ocorrer mesmo no equador. 19
O condado de Uppsala, Suécia, onde Michaelsson, Melhus e outros associaram a ingestão de retinol com DMO reduzido e risco aumentado de fratura em 1998, 7 e da mesma forma associaram os níveis de retinol sérico ao risco de fratura cinco anos depois, 11 está localizado em uma latitude norte de 59,97 graus.20
Usando um modelo online fornecido pela equipe da Engelsen21 e assumindo condições atmosféricas típicas e ausentes de nuvens completas – um fenômeno idealizado e ocorrendo – eu estimo que o inverno de vitamina D de Uppsala se estenderia por um mínimo de cerca de quatro meses, do final de outubro ao final de fevereiro.
No entanto, o ozônio denso e o céu nublado podem fazer com que o inverno da vitamina D se estenda por mais de dez meses, de acordo com julho ao final de maio. O inverno típico da vitamina D provavelmente fica entre os dois.
Níveis baixos de vitamina D em estudos epidemiológicos de vitamina A e osteoporose
Embora Michaelsson e Melhus não relataram a ingestão de vitamina D de homens e mulheres de Uppsala que estudaram em nenhum de seus dois relatórios associando vitamina A com osteoporose, eles escreveram outro relatório sobre um assunto diferente, estudando mulheres de Uppsala e do condado adjacente, Vastmanland, no qual relataram a ingestão de vitamina D organizada por quintil de ingestão de cálcio.
As mulheres no quintil mais baixo de ingestão de cálcio consumiram uma média de apenas 97 IU de vitamina D por dia, enquanto as mulheres no quintil mais alto de ingestão de cálcio consumiram uma média de apenas 185 IU de vitamina D por dia.24
Assim, a um latitude que passa a preponderância do ano coberta sob o crepúsculo de um inverno de vitamina D, os residentes de Uppsala estão consumindo entre um vigésimo e um quadragésimo do que é necessário para manter os níveis séricos ideais de vitamina D.
A maioria dos estudos epidemiológicos que investigam a ligação hipotética entre a vitamina A e a osteoporose não relatou os níveis de vitamina D.
Os poucos dados que podemos colher dos poucos que temos, no entanto, sugerem que as quantidades relativas de vitaminas A e D podem ser mais importantes do que a quantidade de vitamina A sozinha.
No Nurses ’Health Study, que encontrou uma associação positiva entre a ingestão de retinol e o risco de fratura, a ingestão de vitamina D aumentou à medida que a ingestão de retinol aumentou, mas a uma taxa muito menor.
O efeito líquido foi que a proporção de retinol para vitamina D aumentou de 9,7 no quintil mais baixo de ingestão de retinol, que tinha o menor risco de fratura, para 19,34 no quintil mais alto de ingestão de retinol, que tinha o maior risco de fratura.
Os pesquisadores descobriram que a ingestão de vitamina D é protetora, e uma análise multivariada que ajustou para muitas variáveis, incluindo a ingestão de vitamina D, fez com que a associação com a vitamina A se tornasse muito mais pronunciada e consistente.9
Para maximizar a absorção de cálcio, os níveis sanguíneos de 25 (OH) D – a forma de vitamina D que o corpo armazena em suas reservas – devem ser recolhidos em 30 ng / mL (nanogramas por mililitro – um nanograma é um bilionésimo de um grama), que na ausência de luz UV-B, exigiria aproximadamente 2.600 UI de vitamina D por dia para manter.
No entanto, o risco de fratura continua a diminuir em níveis ainda mais elevados de 25 (OH) porque as pessoas realmente caem com menos frequência, sugerindo que esses níveis mais elevados de vitamina D aumentam a coordenação neuromuscular.
Níveis mais altos de vitamina D também conferem benefícios que não estão relacionados ao sistema esquelético: níveis séricos tão altos quanto 46 ng / mL, por exemplo, parecem maximizar a capacidade do corpo de regular o açúcar no sangue.
Trabalhadores agrícolas de pele escura nos trópicos tendem a ter níveis de 25 (OH) D de cerca de 60 ng / mL, sugerindo que o nível ideal de vitamina D está mais próximo desta figura.22
De acordo com o Dr. John Cannel do Vitamin D Council, para manter os níveis séricos de 25 (OH) D na faixa ideal sugerida de 50 ng / mL durante um inverno de vitamina D, deve-se consumir 4000 UI de vitamina D por dia.23 Em contraste, os grupos estudados por Melhus e Michaelsson consumiam muito menos.
Níveis baixos de vitamina D em estudos epidemiológicos de vitamina A e osteoporose
Embora Michaelsson e Melhus não relataram a ingestão de vitamina D de homens e mulheres de Uppsala que estudaram em nenhum de seus dois relatórios associando vitamina A com osteoporose, eles escreveram outro relatório sobre um assunto diferente, estudando mulheres de Uppsala e do condado adjacente, Vastmanland, no qual relataram a ingestão de vitamina D organizada por quintil de ingestão de cálcio.
As mulheres no quintil mais baixo de ingestão de cálcio consumiram uma média de apenas 97 IU de vitamina D por dia, enquanto as mulheres no quintil mais alto de ingestão de cálcio consumiram uma média de apenas 185 IU de vitamina D por dia.24
Assim, a um latitude que passa a preponderância do ano coberta sob o crepúsculo de um inverno de vitamina D, os residentes de Uppsala estão consumindo entre um vigésimo e um quadragésimo do que é necessário para manter os níveis séricos ideais de vitamina D.
A maioria dos estudos epidemiológicos que investigam a ligação hipotética entre a vitamina A e a osteoporose não relatou os níveis de vitamina D.
Os poucos dados que podemos colher dos poucos que temos, no entanto, sugerem que as quantidades relativas de vitaminas A e D podem ser mais importantes do que a quantidade de vitamina A sozinha.
No Nurses ‘Health Study, que encontrou uma associação positiva entre a ingestão de retinol e o risco de fratura, a ingestão de vitamina D aumentou com o aumento da ingestão de retinol, mas a uma taxa muito menor.
O efeito líquido foi que a proporção de retinol para vitamina D aumentou de 9,7 no quintil mais baixo de ingestão de retinol, que tinha o menor risco de fratura, para 19,34 no quintil mais alto de ingestão de retinol, que tinha o maior risco de fratura.
Os pesquisadores descobriram que a ingestão de vitamina D é protetora, e uma análise multivariada que ajustou muitas variáveis, incluindo a ingestão de vitamina D, fez com que a associação com a vitamina A se tornasse muito mais pronunciada e consistente.
O fato de o efeito da vitamina A se tornar mais pronunciado quando a vitamina D foi controlada mostra que o efeito líquido de uma maior ingestão de vitamina A depende não apenas da quantidade de vitamina A consumida, mas também da quantidade de vitamina D consumida com ela.
Como a vitamina D é produzida na pele pela luz solar, mas apenas a vitamina D consumida na dieta, e não os níveis sanguíneos, foi relatada, não podemos saber com certeza o verdadeiro status da vitamina D dos participantes do Nurses ‘Health Study, mas na medida em que dependiam da vitamina D na dieta, a evidência sugere que o aumento nas fraturas de quadril pode ser devido não simplesmente a um aumento na ingestão de vitamina A em si, mas a um aumento na vitamina A consideravelmente desproporcional aos aumentos insignificantes em a ingestão muito baixa de vitamina D.
Em contraste, no estudo de Barker, que encontrou uma associação negativa entre os níveis de retinol sérico e o risco de fratura, a vitamina D sérica aumentou com o aumento do retinol sérico, mas em uma taxa mais alta.
Infelizmente, os pesquisadores não fizeram distinção entre um multivitamínico e óleo de fígado de bacalhau para os 40% dos participantes do estudo que tomaram um ou outro.
No entanto, a menção explícita do óleo de fígado de bacalhau como fonte de suplementação de vitamina A sugere que seu uso foi substancial. Aqueles que não usavam um suplemento tinham níveis médios de retinol sérico de 1,95 µM e níveis médios de 25 (OH) D sérico de 15,24 ng / mL, enquanto aqueles que usavam um multivitamínico ou óleo de fígado de bacalhau tinham níveis médios de retinol sérico de 2,07 µM e níveis médios de 25 ( OH) Níveis de D de 18,88 ng / mL.
Isso representa um aumento nos níveis de retinol sérico de 6,15% e um aumento nos níveis séricos de vitamina D de 23,9%.
Neste estudo, o quartil mais alto de retinol sérico apresentou uma redução de 15 por cento no risco de fratura, enquanto o uso de um multivitamínico ou óleo de fígado de bacalhau, que aumentou os níveis séricos de D em quase quatro vezes a taxa em que aumentou os níveis de retinol sérico, apresentou um equilíbrio mais de 24 por cento diminuíram o risco de fratura. 14
Quando considerados em conjunto, esses dois estudos demonstram que uma maior ingestão ou nível de vitamina A no sangue não leva necessariamente, por si só, a um aumento ou diminuição no risco de fratura; em vez disso, um aumento na vitamina A pode ser prejudicial se não for acompanhado por um aumento suficiente da vitamina D, ou saudável quando acompanhado por tal aumento.
Um estudo que não apóia essa visão é a análise do grupo Lim do Iowa Women’s Health Study.
Embora as taxas de ingestão de retinol e vitamina D dobrassem entre o quintil mais baixo e o mais alto, nenhuma associação de qualquer tipo foi encontrada entre a ingestão de vitamina A e o risco de fratura.
Embora o uso de um suplemento de vitamina A diminuísse a proporção entre a ingestão de retinol e a ingestão de vitamina D, também resultou em um risco aumentado de fratura; uma vez que não houve relação entre a quantidade suplementada e a diminuição do risco, no entanto, a significância do achado é questionável.13
Como observado anteriormente, este estudo sofre de um grande déficit: os pesquisadores usaram apenas um FFQ, uma prática que produziu de forma semelhante resultados nulos no Nurses ‘Health Study, em contraste com os resultados positivos produzidos no Nurses’ Health Study, quando os mesmos pesquisadores usaram todos os cinco FFQs.
Assim como os estudos de qualidade superior demonstram uma relação entre a vitamina A e a osteoporose, os estudos de qualidade superior entre aqueles que relatam o status da vitamina A e o status da vitamina D demonstram que se a vitamina A é prejudicial ou saudável depende do consumo de vitamina D suficiente com ela .
A deficiência de hormônio esteróide imita a deficiência de vitamina D
Por fim, deve-se reiterar que o Nurses ‘Health Study constatou que a associação entre vitamina A e risco de fratura se concentrava em mulheres na pós-menopausa que não usavam terapia de reposição hormonal (TRH).
Quando os pesquisadores realizaram uma análise separada daqueles que usam TRH e aqueles que não usam TRH, não houve relação consistente entre a ingestão de retinol e o risco de fratura entre aqueles que usam TRH, enquanto a análise multivariada rendeu um risco estatisticamente significativo de 252 por cento aumentado no quintil mais alto de vitamina Ingestão entre mulheres que não usam TRH. 9
O estrogênio e outros esteróides sexuais desempenham algumas funções no corpo que são semelhantes às funções desempenhadas pela vitamina D.
Por exemplo, o estrogênio é um inibidor primário da reabsorção óssea em homens e mulheres, 26 enquanto ambos os estrogênios e androgênios aumentam a absorção intestinal e a retenção de cálcio, xii ambos os quais também são papéis desempenhados pela vitamina D. 6
O estrogênio, a testosterona e outros andrógenos também desempenham papéis na facilitação do crescimento ósseo. 25
Pode ser, então, que um declínio nos esteróides sexuais agrave o efeito da vitamina D deficiência, trazendo a atividade semelhante à vitamina D total a um nível baixo o suficiente para que uma maior ingestão de vitamina A comece a se tornar prejudicial.
É esclarecedor que a deficiência de esteróides sexuais parece “ligar” a associação latente entre vitamina A e risco de fratura: isso deve nos dar uma pausa para considerar se essa mesma associação pode ser “ligada” pela deficiência de vitamina D e “desligada” pela suficiência de vitamina D da mesma maneira – muito parecido com o toque de um interruptor de luz.
Paradigmas de pesquisa devem mudar para considerar as relações entre vitaminas
Embora os pesquisadores em geral tenham prestado muito pouca atenção ao equilíbrio entre as vitaminas A e D ao examinar a relação entre a vitamina A e a osteoporose, uma pesquisadora, Sara Johansson, uma pupila de Hakan Melhus, fez dessa relação uma parte central de sua hipótese.
Johansson observou com Melhus em um artigo de 2001 que a ingestão de vitamina D na Escandinávia é freqüentemente deficiente e a luz solar é limitada, concluindo: “Nossa hipótese é que a alta ingestão de vitamina A na Escandinávia pode agravar ainda mais o efeito da hipovitaminose D na absorção de cálcio”. 27
Da mesma forma, Johansson concluiu sua tese de doutorado de 2004 escrevendo: “Minha hipótese é que a alta ingestão de vitamina A na Escandinávia pode agravar ainda mais o efeito da hipovitaminose D na absorção de cálcio e, possivelmente, contribuir para a alta incidência de osteoporose. . .
Também seria interessante ver se o resultado dos estudos epidemiológicos seria diferente se, além do nível de ingestão de vitamina A, fosse levado em consideração o status de vitamina D dos indivíduos ”.
Infelizmente, até Johansson repetiu o erro daqueles que, ao contrário dela, vêem o “excesso” de vitamina A como um fenômeno que opera no vácuo, e não como um fenômeno dependente do equilíbrio com a vitamina D, com estas palavras finais: “Tornou-se claro que as vitaminas não podem ser consideradas pílulas mágicas que só trazem benefícios à saúde,6
Certamente, a afirmação tomada isoladamente é importante e verdadeira.
Sem dúvida, deve haver um ponto além do qual as vitaminas lipossolúveis se tornam prejudiciais em vez de saudáveis, como acontece com todas as substâncias.
Mas sugerir que esta é a lição mais poderosa a ser concluída da pesquisa sobre vitamina A e osteoporose é sugerir que a ingestão de vitamina A na sociedade moderna é atualmente muito alta.
No entanto, existem duas outras possibilidades: primeiro, a ingestão elevada de vitamina A pode ser segura e benéfica quando a vitamina A é consumida na proporção adequada à vitamina D; segundo, uma ampla gama de ingestões e proporções entre as duas vitaminas pode ser aceitável se níveis suficientes de ambas forem mantidos.
A própria pesquisa de Johansson sobre as interações entre as vitaminas A e D, e a conduzida por outros pesquisadores, sugere que as duas últimas possibilidades são explicações muito mais prováveis do que a primeira.
Na verdade, alguns experimentos com animais demonstraram que doses excessivas de vitamina A são seguras quando acompanhadas por doses igualmente grandes de vitamina D.
Antes de revisarmos essa pesquisa fascinante, vamos revisar alguns dos detalhes técnicos do papel da vitamina A no metabolismo ósseo e como ela interage com a vitamina D.
Aprendendo a técnica com as vitaminas A e D: como elas interagem para regular o metabolismo ósseo
Uma introdução à anatomia óssea e ao metabolismo
O osso é um tecido vivo composto principalmente (90-95 por cento) de uma matriz de colágeno, uma variedade de outros tipos de proteínas e cristais de hidroxiapatita depositados, que são feitos principalmente de sais de cálcio e fósforo.
Dentro do osso existem três tipos de células: osteócitos , que escavam canais e vasos sanguíneos através do osso para fornecer suporte nutritivo; osteoclastos , que secretam ácidos e enzimas digestivas de proteínas que dissolvem os ossos; e osteoblastos, que suportam o crescimento do novo osso, secretando a matriz à base de colágeno, que por sua vez atrai a deposição de sais minerais.
Os precursores dos osteoblastos e osteoclastos encontram-se na superfície do osso, cada um dos quais se desenvolve em osteoblastos e osteoclastos maduros e ativos, respectivamente, quando dirigidos para isso por certas moléculas de sinalização.
Como os osteoblastos secretam uma nova matriz óssea, algumas dessas células ficam presas em sua própria matriz e se desenvolvem em osteócitos. 6
A reabsorção óssea, realizada pelos osteoclastos, e o crescimento ósseo, realizado pelos osteoblastos, se complementam e, juntos, formam o processo denominado remodelação óssea, que permite aos ossos otimizar sua forma em resposta aos estímulos ambientais, para se ajustar à ocorrência e reparar lesões e permitir que o corpo regule rigidamente os níveis de cálcio.
Durante a infância e a adolescência, o equilíbrio entre os dois favorece o crescimento ósseo, até que o pico de massa óssea seja alcançado entre as idades de 25 e 30 anos. Idealmente, a manutenção da remodelação óssea uniformemente equilibrada persiste após este ponto, mas normalmente ocorre um desequilíbrio na velhice. em favor da reabsorção óssea, que contribui para a diminuição da densidade mineral óssea (DMO) e, portanto, para a osteoporose. 6
A osteoporose é definida como “um distúrbio esquelético caracterizado por uma redução na massa óssea com danos na microarquitetura que aumenta a fragilidade óssea e o risco de fratura”. 2
A baixa DMO em si só pode ser responsável por 28 por cento das fraturas. O risco de fratura também é determinado pela qualidade mecânica e geometria da junta.
Outro fator no risco de fratura é tão óbvio que pode passar despercebido: a propensão a cair. 6
Isso pode realmente ser, em certo grau, determinado nutricionalmente: conforme discutido acima, um estudo associou altos níveis séricos de vitamina D com diminuição da probabilidade de cair, interpretado por alguns como atribuindo um benefício neuromuscular a altos níveis de vitamina D. 22
Reabsorção óssea: uma função positiva e necessária regulada pelas vitaminas A e D
As formas ativadas das vitaminas A e D, ácido retinóico e calcitriol respectivamente, são ambos hormônios, que são sinais que causam mudanças nas células, alterando a expressão de genes, ou ativando uma ou outra enzima dentro da célula que desempenha alguma função.
O ácido retinóico ativa a reabsorção óssea, aumentando o número e a atividade dos osteoclastos. Também diminui o crescimento de osteoblastos.
O papel frequentemente citado e convencionalmente compreendido do calcitriol é inibir a reabsorção óssea, 6 mas os camundongos que não têm receptor de vitamina D prejudicaram a reabsorção óssea, indicando que o calcitriol também desempenha um papel na estimulação da reabsorção óssea. 28
Embora a reabsorção e o crescimento ósseo sejam em certo sentido “antagônicos”, na verdade são processos complementares. Osteoblastos e osteoclastos se regulam sinergicamente.
Embora os osteoclastos realizem a reabsorção óssea, são os osteoblastos que iniciam o processo, por meio da secreção de sinais que fazem com que as células precursoras dos osteoclastos se desenvolvam em osteoclastos maduros.
À medida que os osteoclastos corroem o osso, vários fatores de crescimento são liberados do osso corroído que, por sua vez, estimulam a maturação dos osteoblastos.
À medida que os osteoblastos amadurecem, eles progressivamente emitem menos sinais de ativação de osteoclastos e mais sinais de inibição de osteoclastos, de modo que a reabsorção óssea diminui gradualmente e, eventualmente, chega a uma parada pouco antes do início do crescimento ósseo. 6
A atividade estimuladora da reabsorção óssea da vitamina A é de vital importância para a saúde óssea. A equipe de Opotowski, que descobriu que os baixos níveis de vitamina A tiveram um efeito tão grande na redução da DMO quanto os altos níveis de vitamina A, sugeriu que a deficiência de vitamina A pode contribuir para o aumento do risco de fratura, permitindo que a matriz óssea cresça mais rápido do que pode ser mineralizada. 12
De fato, embora o efeito líquido da vitamina A seja estimular os osteoclastos e retardar o crescimento dos osteoblastos, a vitamina A também faz com que os osteoblastos secretem uma variedade de enzimas e outras proteínas que são importantes para a mineralização óssea, incluindo a osteocalcina, que é uma proteína que desempenha um papel direto na atração e ligação do cálcio na matriz óssea. 6
Ao desacelerar o crescimento da matriz, mas aumentando a taxa em que é mineralizada, a vitamina A adequada ajuda a garantir densidade óssea suficiente.
O raquitismo, uma doença por deficiência de vitamina D que ocorre em crianças em desenvolvimento, é marcada por um aumento maciço do tecido osteóide (matriz óssea não mineralizada), um aumento no número de osteoblastos e uma incapacidade dos osteoclastos de realizar a reabsorção óssea.
O raquitismo é acompanhado por uma expansão dramática de uma porção do osso chamada placa metafisária, e o volume total do osso pode realmente aumentar.
A versão adulta do raquitismo, a osteomalácia, termo também usado para se referir ao crescimento desregulado dos osteóides que ocorre no raquitismo da infância, às vezes também é acompanhada por uma diminuição no número de células osteoclásticas. 28
Assim, a reabsorção óssea é um processo de vital importância que as vitaminas A e D desempenham um papel na estimulação e regulação.
As vitaminas A e D regulam a absorção intestinal de cálcio e fósforo
O papel principal da vitamina D na saúde óssea não é atuar diretamente nas células ósseas, mas aumentar a absorção intestinal de cálcio.
Camundongos que foram modificados para não possuírem o receptor de vitamina D (VDR) desenvolvem raquitismo e osteomalácia quando alimentados com uma dieta que contém 1% de cálcio e 0,67% de fósforo.
Eles têm 30 vezes o tecido osteóide dos controles, sofrem uma redução de sete vezes na rigidez óssea e experimentam uma expansão acentuada da placa metafisária, um sinal primário de raquitismo.
No entanto, quando a quantidade de cálcio e fósforo na dieta é dobrada, os camundongos sem VDR desenvolvem-se normalmente sem essas alterações. 28
A vitamina D atua através do VDR para aumentar a expressão de várias proteínas nos intestinos que estão envolvidas no transporte de cálcio através da borda intestinal e através das células intestinais para o sangue, e por mecanismos menos conhecidos também aumenta a absorção de fósforo.
Quando a concentração de cálcio na dieta é muito alta, entretanto, o cálcio se difunde passivamente através da borda do intestino. 29 O fósforo, por sua vez, deve ser consumido na proporção adequada ao cálcio – que, em ratos com deficiência de vitamina D é de um para dois 30 – o que explica por que uma dieta rica em cálcio e fósforo seria capaz de contornar os efeitos de uma ausência VDR.
Ainda assim, não podemos descartar um efeito da vitamina D na absorção de cálcio e fósforo mesmo nesses experimentos, uma vez que os camundongos sem VDR ainda consumiam alguma vitamina D.
Em 2005, pesquisadores identificaram uma proteína de mamífero que denominaram 1,25D 3 – MARRS presente na membrana externa das células intestinais induz uma resposta rápida à vitamina D, potencializando o transporte de fósforo 31 e possivelmente de cálcio 32 para o interior da célula, mostrando que nem todas as ações da vitamina D ocorrem através do VDR.
Tanto no rato 33, 34 quanto no humano, 27a vitamina A antagoniza o aumento do cálcio sérico que é induzido pela vitamina D. Johansson e Melhus realizaram o primeiro estudo de intervenção humana in vivo (um estudo in vivo é aquele que utiliza um organismo intacto, em vez de células ou produtos químicos dissociados do organismo) medindo a interação entre as vitaminas A e D, na qual eles descobriram que a vitamina D aumenta o cálcio sérico e a vitamina A reduz o cálcio sérico.
Como nenhuma das vitaminas afetou a taxa de reabsorção óssea ou a quantidade de cálcio na urina, eles concluíram que as alterações no cálcio sérico resultaram de alterações na taxa de absorção intestinal de cálcio.
Uma vez que a ingestão de vitaminas A e D simultaneamente não reduziu a quantidade de metabólitos de cada vitamina no sangue em comparação com a ingestão de uma ou outra sozinha.27
No rato, 33, 34 a diminuição do cálcio sérico é acompanhada por um aumento do fósforo sérico, mas Johansson e Melhus não mediram os níveis de fósforo sérico em humanos.
A vitamina A “interfere na” vitamina D?
Os pesquisadores fizeram várias sugestões sobre os possíveis mecanismos pelos quais a vitamina A pode interferir na função da vitamina D.
Embora o efeito líquido da vitamina A seja promover a reabsorção óssea e o efeito líquido da vitamina D seja inibir a reabsorção óssea, cada vitamina também desempenha um papel no processo oposto: camundongos que não têm receptor de vitamina D perdem sua capacidade de se envolver no osso reabsorção 28 e um estudo mostrou que a vitamina A inibia a reabsorção óssea. 6
A vitamina A também aumenta a produção corporal de fatores de crescimento, alguns dos quais estimulam os osteoblastos e, portanto, o crescimento ósseo. 12
Portanto, é excessivamente simplista dizer que as duas vitaminas são “antagônicas” nesse aspecto.
Da mesma forma, embora seja verdade que quando as vitaminas A e D são administradas juntas, D tende a diminuir o fósforo sérico e aumentar o cálcio sérico, enquanto A tende a diminuir o cálcio sérico e aumentar o fósforo sérico, os mecanismos moleculares desse processo não são compreendidos.
A vitamina D é necessária para a absorção de ambos os minerais do intestino, 29 portanto, pode ser que a vitamina A atue como um modulador da vitamina D, controlando em que grau ela aumenta a captação de um mineral em relação ao outro.
Assim, as ações “antagônicas” aparentes das vitaminas A e D não são exemplos claros de certo antagonismo, e os mecanismos relevantes pelos quais a vitamina A pode interferir ativamente na função da vitamina D são também não demonstrado ou refutado.
Quanta vitamina A é demais? A pergunta errada a fazer
Agora que estabelecemos que o papel da vitamina A no metabolismo ósseo é positivo e que sua interação com a vitamina D é de um caráter complexo que inclui sinergismo em vez de simplesmente antagonismo, vamos nos voltar para a evidência concreta: experimentos em humanos e animais sugerem que vitamina D suficiente – algo que nenhum dos grupos estudados nos relatórios epidemiológicos que ligam a vitamina A à osteoporose – anula o efeito da vitamina A na promoção de uma saúde esquelética deficiente.
Dito de outra forma, não é a vitamina A em si que contribui para a saúde esquelética deficiente; é a combinação de vitamina A comparativamente alta e vitamina D deficiente.
Portanto, a questão que está sendo feita por esses estudos epidemiológicos – ou seja, “quanta vitamina A é demais?” – é totalmente errado.
Existem três modelos básicos que podemos usar para avaliar o efeito de uma determinada quantidade de vitamina A. O primeiro é considerar a quantidade absoluta.
O segundo seria um modelo de proporção, em que a importância da quantidade absoluta de vitamina A está sujeita à importância da proporção entre as vitaminas A e D.
O terceiro é um limite ou modelo de “troca”, em que a associação entre vitamina A e a osteoporose pode ser “ligada” por níveis deficientes de vitamina D e da mesma forma “desligada” por níveis de vitamina D atingindo um certo nível de suficiência, como um interruptor de luz.
Vários grupos de pesquisadores publicaram estudos que investigam os efeitos de várias combinações de vitaminas A e D na absorção de cálcio e fósforo, níveis séricos desses minerais, densidade mineral óssea, outras medidas de saúde esquelética ou alguma combinação delas,
Evidência Humana
Como observado anteriormente, Myrhe e outros conduziram uma meta-análise de todos os relatos de casos de hipervitaminose A publicados no ano 2000, que estabeleceram em humanos o princípio de que a toxicidade da vitamina A depende não apenas da ingestão de vitamina A, mas também sobre a ingestão de vitamina D.
Embora a análise estabeleça claramente esse princípio, não esclarece se essa interação constitui uma proporção ou um modelo de troca.
Os pesquisadores descobriram que a dose média de vitamina A relatada como tóxica era 175.000 UI maiorse a vitamina D também estava sendo suplementada, mas eles não analisaram a quantidade real de vitamina D ingerida, tornando impossível determinar qual dos modelos acima os dados corroboram melhor.
Além disso, embora 46 por cento dos casos de toxicidade envolvessem níveis elevados de cálcio no sangue, provavelmente devido a um excesso de reabsorção óssea estimulada pela vitamina A (e, portanto, um efluxo de cálcio do osso para o sangue), o efeito da suplementação de vitamina D sobre nenhum destes nem qualquer outro critério de toxicidade específico para a saúde esquelética foi estudado. 15
Em 2001, Sara Johansson, que formulou a hipótese em sua tese de doutorado de que o excesso de vitamina A contribui para a osteoporose ao agravar os efeitos da deficiência de vitamina D, 6 e seu tutor, Hakan Melhus, que publicou o primeiro estudo associando a ingestão de vitamina A ao risco de fratura de quadril , 7juntos publicaram um estudo cruzado duplo-cego demonstrando que as vitaminas A e D têm efeitos antagônicos nos níveis de cálcio sérico em humanos.
Este é, até agora, o único estudo controlado de intervenção humana que eu conheço que investigou os efeitos interativos das vitaminas A e D no sistema esquelético.
Johansson e Melhus descobriram que 50.000 UI de vitamina A como palmitato de retinila diminuíram os níveis de cálcio sérico, enquanto 2 µg (microgramas, ou milionésimos de grama) de calcitriol, ou vitamina D ativada, aumentaram os níveis de cálcio sérico.
(Em peso, 2 µg de calcitriol é equivalente a 6,66 IU de colecalciferol, ou vitamina D não ativada, mas como IU é uma medida do efeito fisiológico e o efeito fisiológico por unidade de peso do calcitriol é muito mais poderoso do que o do colecalciferol , não podemos expressar a quantidade de calcitriol em termos de UI.)
Os níveis de cálcio sérico aumentaram quando as vitaminas A e D foram administradas juntas, mas menos do que quando a vitamina D foi administrada sozinha.
Embora um aumento na taxa de reabsorção óssea aumentasse o cálcio sérico, nenhuma das vitaminas alterou a taxa de reabsorção óssea. Da mesma forma, embora uma vitamina pudesse exercer um efeito antagônico sobre a outra, bloqueando sua absorção, nenhuma das vitaminas parecia afetar a absorção da outra.
Finalmente, embora uma diminuição na taxa de excreção de cálcio do sangue para a urina aumente o cálcio sérico, nenhuma das vitaminas alterou a quantidade de cálcio na urina.
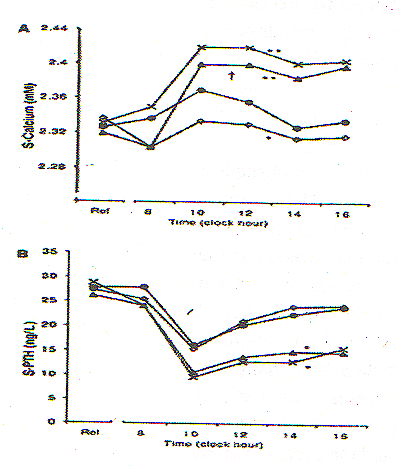
Figura 2
As linhas com X representam o efeito da vitamina D administrada sozinha; as linhas com losangos representam o efeito da vitamina A administrada sozinha; as linhas com círculos representam o efeito do controle de placebo; as linhas com triângulos representam o efeito das vitaminas D e A administradas juntas.
Os asteriscos indicam que o efeito é estatisticamente significativamente diferente do efeito do placebo; uma cruz indica que o efeito é estatisticamente significativamente diferente do efeito da vitamina D sozinha.
A. A vitamina A sozinha deprime o cálcio sérico em relação ao controle com placebo, enquanto as vitaminas A e D administradas juntas aumentam o cálcio sérico quase tanto quanto a vitamina D sozinha.
B. A vitamina D reduz os níveis de hormônio da paratireóide (PTH), um sinal de deficiência de vitamina D, em relação ao controle.
Usando o gráfico publicado por Johansson e Melhus reproduzido na Figura 2 , estimo que o cálcio sérico caiu 0,77 por cento em comparação com o grupo do placebo quando a vitamina A foi administrada sozinha, aumentou 3,25 por cento quando a vitamina D ativada foi administrada sozinha e aumentou 2,87 por cento quando as vitaminas A e D foram administrados juntos.
Como este estudo testou apenas uma quantidade de cada vitamina, é impossível saber se ela se encaixa em um modelo de proporção ou em um modelo de switch, mas uma coisa é certa: a quantidade absoluta de vitamina A é irrelevante.
Na verdade, o efeito da vitamina A nos níveis de cálcio sérico era tão dependente do status de vitamina D dos indivíduos que parecia ter o efeito oposto quando administrado sozinho, de reduzir o cálcio sérico, do que quando administrado junto com a vitamina D, de aumentar o cálcio sérico.
Embora comparar o efeito das vitaminas A e D juntas com os efeitos das vitaminas A e D sozinhas nos ajude a distinguir os efeitos de cada uma – algo que é interessante no sentido acadêmico – aqueles de nós que comem uma dieta rica em todas as vitaminas estão interessados no conhecimento mais prático sobre se o componente de vitamina A de uma dieta rica em nutrientes é prejudicial.
Claramente, como pode ser visto pelo gráfico da Figura 2 , a lição do estudo de Johansson e Melhus é que as vitaminas A e D juntas são muito eficazes no aumento dos níveis de cálcio sérico.
Um exame das evidências mais extensas sobre animais nos assegurará ainda mais da segurança e dos benefícios de uma dieta rica em nutrientes.
Evidência animal: ratos
Um grupo de pesquisadores liderado por Cynthia Rhode investigou a interação das vitaminas A e D2 na dieta de ratos. 33 A vitamina D 2 é um tipo de vitamina D sintetizada a partir do ergosterol, uma substância química encontrada nas gorduras vegetais e que normalmente não é encontrada em quantidades significativas na dieta.
É inútil em pássaros porque não tem afinidade pela proteína que armazena e transporta a vitamina D no sangue; trata com eficácia o raquitismo e a deficiência grave de vitamina D em mamíferos, incluindo humanos, mas é até 10 vezes menos eficaz do que a vitamina D 3 na manutenção do status de vitamina D em humanos, o que é necessário para uma variedade de outros parâmetros de saúde . 34a
Os pesquisadores alimentaram ratos de 21 dias com uma dieta deficiente em fósforo, destinada a produzir raquitismo.
Eles forneceram cinco doses de vitamina A variando de 0 a cerca de 29.000 UI por dia, que é o equivalente ajustado ao peso corporal de um humano de 75 kg tomando cerca de 39.000.000 UI de vitamina A por dia.
Eles forneceram seis doses de vitamina D2 variando de 0 a cerca de 26 UI por dia, que é o equivalente ajustado ao peso corporal de um humano de 75 kg tomando cerca de 35.000 UI de vitamina D por dia.
Quando nenhuma vitamina D 2 foi administrada, a dose mais baixa de vitamina A, equivalente a cerca de 52.000 UI para um humano de 75 kg, aumentou a mineralização óssea, enquanto doses mais altas de vitamina A diminuíram a mineralização óssea.
Para todas as outras doses de vitamina D 2, o aumento da dose de vitamina A reduziu progressivamente a quantidade total de mineralização óssea.
A vitamina A também reduziu progressivamente a densidade mineral óssea (que é a quantidade de mineralização para um determinado volume de osso, em vez da quantidade total de mineralização), exceto no nível que se aproxima do equivalente humano de 40 milhões de UI por dia, o que causou um redução acentuada no crescimento, permitindo que a densidade mineral óssea permaneça constante à medida que menos minerais são depositados em um fêmur menor.
Este estudo refuta claramente um modelo em que a quantidade absoluta de vitamina A é o único fator operativo.
Considerando que, quando a vitamina D 2 foi mantido constante, o aumento vitamina A diminuição da mineralização óssea, reuni de dados na Tabela 1 mostra que quando a vitamina D 2 foi deixada a aumentar com a vitamina A, vitamina A aumentando em vez aumentou a mineralização óssea.
Uma vez que este estudo mostrou que a vitamina A tem um efeito antagônico mesmo no nível mais alto de vitamina D 2 , no entanto, ele apóia um modelo de proporção, em vez de uma troca.
Tabela 1
Apenas uma parte dos dados é mostrada, simplesmente para elucidar a importância relativa das quantidades absolutas de vitamina A quando analisadas isoladamente.
A ingestão de vitaminas é expressa como equivalentes ajustados ao peso corporal para um humano de 75 kg.
| Vitamina D2 (UI / 75 kg / dia) | Vitamin A (IU/75 kg/day) | Total de cinzas de fêmur (mg) |
| 0 | 0 | 30.5 |
| 0 | 51,818 | 34.5 |
| 284 | 15,657,273 | 36.7 |
| 1418 | 39,145,909 | 46.5 |
Em contraste, o mesmo grupo de pesquisadores publicou um estudo mais elaborado e muito mais útil no ano passado, que apóia um modelo de troca, em vez de proporção.
Os pesquisadores testaram como diferentes combinações de vitaminas A e D interagem para afetar as concentrações séricas de cálcio e fósforo.
Eles usaram duas formas de vitamina A, acetato de retinila e o hormônio ativado ácido all- trans retinóico (ATRA), e quatro formas de vitamina D: vitamina D 2 , vitamina D 3 , o hormônio ativado calcitriol e uma variante sintética do calcitriol. 34
Ao contrário do primeiro estudo, os pesquisadores usaram uma dieta com concentrações normais de cálcio e fósforo neste estudo, tornando-a mais relevante para a questão prática de quanta vitamina A incluir em umdieta saudável , em vez da questão acadêmica de como as duas vitaminas interagem dentro de uma dieta que produz doenças.
Quando os ratos consumiram uma quantidade de vitamina D 2 equivalente a uma dose humana diária de pouco menos de 500 UI, a vitamina A como acetato de retinila diminuiu o cálcio sérico e aumentou o fósforo sérico; no entanto, com uma quantidade de vitamina D 2 equivalente a uma dose humana diária de pouco mais de 900 IU, mesmo uma quantidade de vitamina A superior ao equivalente humano diário de 5.000.000 IU não poderia reduzir os níveis de cálcio sérico, embora a vitamina A continuasse a aumentar os níveis de fósforo sérico.
Na verdade, quando a quantidade de vitamina D 2 era equivalente a uma dose humana de cerca de 1400 IU por dia, a quantidade de vitamina A equivalente a uma dose humana de mais de 5.000.000 IU por dia aumentou substancialmente os níveis de cálcio sérico e fósforo sérico ( Tabela 3 ).
Da mesma forma, o ácido retinóico ativado só foi capaz de diminuir o cálcio sérico e aumentar o fósforo sérico em baixas doses de calcitriol ativado.
Quando os ratos consumiram doses mais altas de calcitriol, essa capacidade do ácido retinóico foi “desligada” como um interruptor de luz.
Infelizmente, os pesquisadores testaram apenas uma dose de vitamina D3.
Quando os ratos foram alimentados com uma quantidade de vitamina D 3 equivalente a uma dose humana diária de cerca de 500 UI, quantidades de vitamina A equivalente a doses diárias de humanos 2600000 UI UI e 5.000.000 ambos de cálcio no soro reduzido e fósforo séricas elevadas. Uma quantidade de vitamina A equivalente a uma dose diária humana de pouco mais de 17.000 UI, no entanto, causou um pequeno (mas não estatisticamente significativo) aumento no cálcio sérico e, na verdade, causou uma diminuição estatisticamente significativa nos níveis de fósforo sérico.
Uma vez que a vitamina D 3 (mostrada na Tabela 2 ) foi administrada apenas em uma dose insuficiente para “virar o interruptor”, os dados inicialmente parecem apoiar um modelo de proporção. Os dados de vitamina D 2 apresentados na Tabela 3, entretanto, estabelecem um modelo de troca inequívoco.
Tabela 2
Quando a vitamina D3 foi fornecida em uma quantidade abaixo do limite de troca de 938 IU, exibiu um modelo de razão, mas se compararmos os dois valores para 17.255 IU de vitamina A, fica claro que a quantidade absoluta de vitamina A é irrelevante.
A ingestão de vitaminas é apresentada como equivalentes ajustados ao peso corporal para um ser humano de 75 kg.
| Vitamin A (IU/75 kg/day) | Vitamina D3 (UI / 75 kg / dia) | Cálcio sérico (mM) | Fósforo sérico (mM) |
| 17,255 | 0 | 1.10 | 3.35 |
| 0 | 454 | 2.15 | 3.06 |
| 17,255 | 454 | 2.30 | 2.41 |
| 2,603,455 | 454 | 2.08 | 2.84 |
| 5,146,364 | 454 | 1.73 | 3.23 |
Tabela 3
Quando a vitamina D2 foi fornecida abaixo do limite de troca de 938 UI, a vitamina A diminuiu o cálcio sérico. A diminuição muito pequena no cálcio sérico médio que ocorreu quando 938 UI de vitamina D2 foram administrados não foi estatisticamente significativa. Uma vez que o “interruptor” foi “acionado”, a vitamina A realmente aumentou o aumento do cálcio sérico.
| Vitamin A (IU/75 kg/day) | Vitamina D2 (UI / 75 kg / dia) | Cálcio sérico (mM) | Fósforo sérico (mM) |
| 17,255 | 0 | 1.23 | 3.74 |
| 0 | 469 | 1.95 | 2.65 |
| 5,206,909 | 469 | 1.40 | 4.58 |
| 0 | 938 | 2.33 | 2.87 |
| 5,206,909 | 938 | 2.25 | 3.87 |
| 0 | 1407 | 2.20 | 2.81 |
| 5,206,909 | 1407 | 2.50 | 3.45 |
Evidência animal: frangos de corte
Uma equipe de pesquisadores liderada por Whitehead publicou um relatório em 2004 mostrando que em várias concentrações de vitamina D 3 na alimentação, alterar a concentração de vitamina A na alimentação de 2,4 mg / kg para 4,5 mg / kg não teve efeito na mineralização óssea, resistência óssea, ou cálcio sérico em frangos de corte. 35
Os autores não relataram a quantidade de comida consumida por cada frango por dia, mas usei dados de outro estudo, 36 para estimar que as duas doses de vitamina A eram equivalentes a doses humanas diárias ajustadas ao peso corporal de cerca de 69.000 UI e 130.000 IU.
Embora este estudo não tenha encontrado nenhum efeito antagonista da vitamina A em qualquer nível de vitamina D, o mínimoA ingestão de vitamina D no estudo foi equivalente a uma dose diária humana de mais de 1700 UI.
Esta ingestão mínima de vitamina D está bem acima da ingestão de vitamina D (938 UI por dia) que desligou o efeito antagônico da vitamina A para ratos no estudo anterior.
Assim, este estudo é consistente com um modelo de troca, em que os pesquisadores administraram vitamina D suficiente para desligar o efeito negativo da vitamina A em todos os grupos de tratamento.
Aburto e Britton publicaram dois estudos anteriores em 1998 usando a mesma raça de frango de corte, ambos os quais suportam um modelo de switch, mas também estabelecem o limite de vitamina D 3 necessário para virar o switch como consideravelmente mais alto do que o estabelecido por Rhode e Whitehead estudos.
No primeiro, 37 o aumento da quantidade de vitamina A de cerca de 38 equivalente a uma dose diária humana de cerca de 12.000 IU para quase 370.000 IU reduziu estatisticamente as cinzas ósseas de forma significativa, mas apenas quando as galinhas foram protegidas de toda a luz ultravioleta e alimentadas com o equivalente de uma dose humana diária de cerca de 4000 UI de vitamina D 3 .
No equivalente a uma dose humana diária de cerca de 21.000 UI de vitamina D 3por outro lado, a vitamina A não teve efeito estatisticamente significativo.
Quando os pintinhos foram expostos à luz ultravioleta, a dose de vitamina A não teve efeito sobre as cinzas ósseas e nenhuma interação com a vitamina D em qualquer dose de qualquer uma das vitaminas.
Uma vez que não houve diferença estatisticamente significativa na cinza óssea entre qualquer uma das seis diferentes proporções de vitamina A para D consumidas por galinhas expostas à luz ultravioleta, este estudo suporta um modelo de switch, em que a luz ultravioleta, bem como alguma quantidade dietética de vitamina D 3entre os equivalentes humanos de 4.000 e 21.000 IU por dia, fornece um nível suficiente de vitamina D para desligar o efeito da vitamina A.
Embora o estudo de Whitehead tenha descoberto que uma dose muito mais baixa de vitamina D foi suficiente para “desligar” o efeito antagônico de vitamina A na mesma raça de frango, os autores desse estudo forneciam vinte e três horas de luz por dia.
Eles não especificaram o tipo de iluminação que usaram, mas como não tomaram nenhuma medida deliberada para proteger seus pintinhos da luz ultravioleta, a iluminação pode ter fornecido vitamina D adicional aos pintinhos.
No segundo estudo de Aburto e Britton, 39 a interação entre as vitaminas A e D foi estudada usando três tipos de vitamina D: vitamina D 3 , o metabólito semi-ativado, 25 (OH) D e o metabólito totalmente ativado, calcitriol.
Os pesquisadores protegeram os filhotes de todos os grupos da luz ultravioleta.
Para qualquer quantidade dada de vitamina D 3 , aumentando a quantidade de vitamina à partir de uma estimativa de 40 equivalente a uma dose humana diária de cerca de 12.000 UI para que a de cerca de 370000 UI diminuição da mineralização óssea e aumento da incidência de raquitismo.
Isso era verdade mesmo com uma quantidade de vitamina D 3 equivalente a uma dose humana diária de mais de 26.000 UI.
À primeira vista, este estudo parece apoiar um modelo de razão. No entanto, as doses de vitamina A usadas nos grupos com alto teor de vitamina A e baixo teor de vitamina A eram tão díspares que é impossível comparar proporções equivalentes de vitamina A para vitamina D entre os dois grupos: o mais alto teor de vitamina A para vitamina A proporção D no grupo com baixo teor de vitamina A foi de 7,5, enquanto a proporção mais baixa de vitamina A para vitamina D no grupo com alto teor de vitamina A foi de 14.
Para referência, o óleo de fígado de bacalhau com alto teor de vitamina tem vitamina A para vitamina Razão D de 10. Mesmo que a dose elevada de vitamina A mencionada tenha quase o dobro da razão A-D da dose baixa de vitamina A mencionada, ela realmente produziu um aumento de 24% na mineralização óssea e uma diminuição de 77%na incidência de raquitismo.
Isso mostra claramente que, desde que as proporções estejam dentro de uma faixa razoável, é melhor ingerir mais das duas vitaminas – como se obteria com óleo de fígado de bacalhau rico em vitaminas – do que menos das duas vitaminas.
Uma vez que consideramos a interação da vitamina A com os metabólitos semi-ativados e ativados da vitamina D, fica claro que este estudo está de acordo com um modelo de switch.
O metabólito semi-ativado, 25 (OH) D, que é cerca de duas vezes mais ativo que a vitamina D 3 em frangos de corte, em uma quantidade equivalente a uma dose humana diária de quase 3.000 IU, 40a foi capaz de desligar completamente a associação entre vitamina A e a gravidade do raquitismo, enquanto uma quantidade equivalente a uma dose diária humana de quase 6.000 UI foi capaz de desligar completamente a associação da vitamina A com o aumento da incidência de raquitismo e diminuição da cinza óssea.
Da mesma forma, o metabólito totalmente ativado, calcitriol, que é cerca de dez vezes mais ativo que a vitamina D 3em frangos de corte, em uma quantidade equivalente a uma dose diária humana de cerca de 2.600 UI, foi capaz de desligar completamente a associação entre a vitamina A e a incidência e severidade do raquitismo.
A vitamina A não afetou a mineralização óssea quando administrada em conjunto com qualquer dose de calcitriol.
Os três estudos com frangos de corte tomados em conjunto suportam um modelo de troca, onde vitamina D suficiente desativa a associação entre vitamina A e defeitos ósseos.
A evidência mais convincente para isso é que a luz ultravioleta, que se fornecida em quantidade suficiente é capaz de fornecer totalmente a necessidade exata de vitamina D, 17 foi capaz de abolir completamente o efeito negativo da vitamina A.37
No entanto, a dose dietética necessária para virar desligar o interruptor na ausência de luz ultravioleta – equivalente a uma dose humana diária de 20.000 UI – era surpreendentemente alto.
Isso provavelmente ocorre porque, conforme explicado pelos autores do estudo Whitehead, as raças modernas de frangos de corte têm uma necessidade geneticamente aumentada de cálcio.
Os pesquisadores forneceram aos pintinhos apenas 75% do cálcio de que os frangos modernos precisam.oito vezes – uma razão pela qual o raquitismo e outros sinais de deficiências de cálcio e vitamina D freqüentemente se manifestam entre frangos de corte em condições comerciais, embora as dietas desses frangos sejam frequentemente fortificadas com grandes quantidades desses nutrientes. 35
Rhode e Deluca mostraram que uma simples quantidade de vitamina D equivalente a uma dose humana diária de pouco mais de 900 UI foi capaz de desligar o efeito negativo da vitamina A nos níveis de cálcio sérico de ratos, que, como mamíferos, estão mais próximos dos humanos do que são galinhas, mesmo quando os ratos consumiam quantidades de vitamina A que ultrapassavam o equivalente a uma dose humana diária de 5.000.000 UI. 34
Esta quantidade de vitamina D necessária é equivalente a menos de um quarto da dose humana recomendada pelo Conselho de Vitamina D, o que sugere que seguir as recomendações de vitamina D do Conselho pode, por si só, desligar qualquer efeito negativo da vitamina A em humanos.
Esse mesmo equivalente de dose é, por outro lado, duas vezes a quantidade de vitamina D que os participantes do Nurses ‘Health Study consumiam no quintil mais alto e seis vezes a quantidade que estavam consumindo no quintil mais baixo, embora seja cinco vezes o quantidade de vitamina D que os residentes de Uppsala, na Suécia, consumiam no quintil mais alto e 10 vezes o que consumiam no quintil mais baixo.
Isso sugere que os estudos que associam a vitamina A à osteoporose nessas populações podem não ter relevância para aqueles de nós que consumimos quantidades insuficientes de vitamina D.aumentou o aumento dos níveis de cálcio sérico quando os ratos consumiram uma quantidade um pouco maior de vitamina D, pode ser que a vitamina A possa ajudar a prevenir a osteoporose em populações que consomem vitamina D suficiente.
Rumo a uma nova compreensão da toxicidade da vitamina: equilíbrio versus quantidade
A esta altura, deve estar claro que um alto nível de vitamina A não causa, por si só, a osteoporose.
A vitamina A só pode exercer os efeitos nocivos atribuídos a ela no contexto da deficiência de vitamina D, o que significa que não é um excesso de vitamina A que contribui para a osteoporose, mas um desequilíbrio entre as vitaminas A e D.
Embora a vitamina A exerça os efeitos que se acredita contribuir para a osteoporose em níveis que estão bem abaixo do que é convencionalmente entendido como “tóxico”, o próprio princípio de que seus efeitos são modificados pela vitamina D põe em questão o entendimento convencional da própria toxicidade da vitamina.
Se certas vitaminas devem ser ingeridas em certo equilíbrio, os efeitos tóxicos de uma dada em excesso, desproporcional às outras, são atribuíveis a um excesso dessa vitamina ou, em vez disso, a uma deficiência relativa das outras vitaminas que devem acompanhar isto?
Não sou de forma alguma o primeiro escritor a sugerir tal interação. Os pesquisadores fizeram a primeira insinuação de tal interação em 1936, quando Tabor mostrou altas doses de carotenos para interferir na disponibilidade de vitamina D para tratar o raquitismo em vacas. 34
Numerosos estudos com animais mostraram que a vitamina A reduz a toxicidade da vitamina D e a vitamina D reduz a toxicidade da vitamina A. 6
Ainda assim, em 2003, Myhre e outros encontraram apenas 81 casos de hipervitaminose A em 259 que relataram se a vitamina era ou não D estava sendo complementado, 15 poucos dos estudos epidemiológicos sobre vitamina A e risco de fratura relatam a ingestão de vitamina D, e é raro que os especialistas em saúde alertem sobre os danos do “excesso” de vitamina A observarem que sua segurança depende da ingestão concomitante de vitamina D.
Um estudo final em animais 41 que discutirei, publicado em 1985 por uma equipe de pesquisadores liderada por Metz, mostra que a toxicidade de cada uma das vitaminas A e D depende da quantidade fornecida uma da outra tanto quanto da quantidade fornecida de em si.
Os pesquisadores alimentaram perus com dietas deficientes em ambas as vitaminas, suficientes em ambas as vitaminas, excessivas em vitamina A, excessivas em vitamina D ou excessivas em ambas.
Os pesquisadores fortificaram o excesso da dieta de vitamina A com 400.000 UI de vitamina A por kg de alimento e o excesso da dieta de vitamina D com 900.000 UI de vitamina D 3por kg de alimento.
Os autores não relataram a quantidade de comida que os perus comiam, mas estimaram que o grupo com alto teor de vitamina A consumiu 15.000 UI por dia, o que é, após ajuste para o peso corporal, equivalente a um humano ingerindo mais de 3.500.000 UI por dia.
Como os perus dos outros grupos pesavam quase o dobro, é possível que eles consumissem o dobro da comida, o que significa que o grupo alimentado com grandes quantidades de ambas as vitaminas consumiu doses humanas equivalentes entre 3,500.000 e 7.000.000 UI por dia de vitamina A, e entre 8.000.000 e 16.000.000 UI por dia de vitamina D.
As dietas foram fornecidas por 25 dias.
Nos grupos alimentados com dieta deficiente ou com dieta rica em vitamina A, as aves tiveram crescimento retardado, claudicação e, eventualmente, não conseguiam andar.
No grupo com alto teor de vitamina A, as aves tinham densidade mineral óssea mais baixa, ossos finos, várias lesões esqueléticas, zonas de crescimento mal definidas dentro dos ossos e fraturas espontâneas. No grupo com alto teor de vitamina D, as aves apresentavam rins inchados e pálidos e depósitos minerais nos rins.
Ainda assim, no grupo alimentado com grandes quantidades de ambas as vitaminas, todos os efeitos tóxicos de ambas desapareceram completamente!
Não devemos concluir que é necessariamente seguro para humanos tomar as mesmas quantidades de vitaminas fornecidas aos perus neste estudo, porque perus e humanos não têm necessariamente as mesmas necessidades de vitaminas, e a duração do estudo foi de apenas 25 dias.
No entanto, o estudo demonstra claramente que o antigo paradigma em que a toxicidade de uma vitamina é função dessa vitamina é falso, e que um novo paradigma – de que a toxicidade de uma vitamina depende de seu equilíbrio com outras vitaminas – que tem sido avançado em segundo plano por vários pesquisadores nos últimos setenta anos, é necessário.
Interações entre as vitaminas A, D, E e K
A pesquisa não apenas demonstrou uma interação entre as vitaminas A e D, mas também demonstrou interações entre todas as vitaminas solúveis em gordura.
Quando os pesquisadores alimentam ratos com vitamina A 10 vezes a quantidade normal, os níveis séricos de vitaminas E e D caem; quando alimentam ratos com vitamina A 50 vezes a quantidade normal, os níveis séricos de vitamina K também caem.
Um sintoma da toxicidade da vitamina A e da vitamina E no rato – hemorragia interna – se assemelha a um sintoma importante da deficiência de vitamina K, sugerindo que parte da toxicidade das vitaminas A e E pode ser devido a um desequilíbrio com a vitamina K.
Um estudo mostrou mostraram interações entre as vitaminas A, D, E e K em galinhas. 42
Como a vitamina A, Aburto e Britton também mostraram doses extremas de vitamina E para reduzir as cinzas ósseas e o cálcio plasmático e para aumentar o raquitismo em galinhas – efeitos todos remediados com a alimentação de altas doses de vitamina D. 37
Vários estudos, quando considerados em conjunto, sugerem que a vitamina E pode interferir com o funcionamento ou aumentar a necessidade da vitamina A.
Em Nutrição e Degeneração Física , Weston Price descreveu a importância da vitamina A para o desenvolvimento do tecido ocular e citou experimentos realizado por Fred Hale, em que porcos com deficiência de vitamina A deram à luz filhos com uma variedade de defeitos oculares, incluindo cegueira e, em alguns casos, ausência de globos oculares. 43
Em um estudo mais recente, 44os pesquisadores injetaram o poluente ambiental TCDD, a dioxina mais potente, a vitamina E como succinato de a-tocoferol e a vitamina A como acetato de retinol em ovos contendo embriões de galinha, e então deixaram os pintos chocar.
A vitamina A e a vitamina E protegiam contra defeitos congênitos induzidos por TCDD, mas a vitamina E causava seus próprios defeitos congênitos – principalmente anormalidades oculares.
Uma garota, como alguns dos porcos com deficiência de vitamina A de Fred Hale, até nasceu sem olhos.
O TCDD, que atua como um hormônio e imita a vitamina A e se opõe à vitamina A de várias maneiras, 45 ajudou a reduzir os defeitos congênitos induzidos pela vitamina E, mas os pesquisadores não testaram se a vitamina A protegia ou não contra esses defeitos congênitos.
Em humanos, a vitamina A ajuda a melhorar a retinite pigmentosa da doença ocular, enquanto a vitamina E a acelera. 46Se altas doses de vitamina E podem induzir os mesmos defeitos oculares induzidos por doses deficientes de vitamina A, e se a vitamina E acelera as mesmas doenças oculares que são ajudadas pela vitamina A, então os efeitos tóxicos da vitamina E nos olhos podem resultar de uma depleção de vitamina A.
De fato, doses excessivas da forma a-tocoferol da vitamina E não apenas interferem no funcionamento da vitamina A, mas na verdade interferem no funcionamento da própria vitamina E, ao inibir a ação de outras partes importantes do complexo de vitamina E. 47
Todas essas descobertas demonstram a importância de uma dieta rica em nutrientes como um todo, em que os nutrientes ocorrem naturalmente em proporções equilibradas, e a tolice de atribuir a culpa pela toxicidade a uma vitamina em si, sem levar em conta sua interação com outras vitaminas.
| A vitamina A ainda é uma vitamina Em um boletim informativo recente, o Dr. John Cannel, do conselho da vitamina D, alertou contra tomar óleo de fígado de bacalhau como fonte de vitamina D, porque os retinóis – vitamina A pré-formada – interferem na função da vitamina D. O Dr. Cannel sugeriu a obtenção de ômega-3 ácidos graxos de óleos de peixe e vitamina A de carotenos. 4 Esse conselho eleva o status da vitamina D em relação à vitamina A e tem uma visão simplista de suas ações “antagônicas”. A vitamina A é necessária para o crescimento, imunidade, produção de esteróides, produção de esperma nos homens, prevenção do aborto espontâneo nas mulheres e desenvolvimento pré-natal adequado. 45 A vitamina A parece ajudar na utilização da proteína dietética e, embora os andrógenos sejam usados como promotores do câncer de próstata, a vitamina A aumenta a produção de andrógenos e inibe fortemente o câncer de próstata. 48 Alimentos ricos em vitamina A, como suco de fígado cru, têm sido usados com sucesso para tratar o câncer, 49 e doses concentradas de ácido trans- retinóico de ocorrência natural , a forma de hormônio ativo da vitamina A, são usadas atualmente como um tratamento de grande sucesso para a leucemia. 50 A vitamina A parece proteger contra doenças inflamatórias e se esgotar. 51 A vitamina A também protege contra as toxinas ambientais e contra os danos dos radicais livres: o óleo de fígado de bacalhau, de fato, por causa de seu teor de vitamina A, é a única fonte de ácidos graxos essenciais que podem reduzir os níveis de peróxidos lipídicos de radicais livres prejudiciais , enquanto todas as outras fontes de ácidos graxos essenciais aumentam os peróxidos lipídicos. 45 Algumas das ações positivas da vitamina D só ocorrem na presença da vitamina A. Por exemplo, a forma de hormônio ativo da vitamina A, o ácido retinóico, é atualmente usada para induzir a diferenciação das células leucêmicas, o que as torna não cancerosas. Pesquisas recentes mostram que a forma de hormônio ativo da vitamina D, calcitriol, aumenta o efeito da vitamina A quando os dois são administrados juntos, mas não tem efeito positivo por si só, tornando a vitamina A necessária para o efeito inibidor do câncer da vitamina D neste caso. 50 Pesquisas com animais também mostram que mesmo a ingestão moderada de vitamina D aumenta a necessidade do corpo por vitamina A. Aburto e colegas, por exemplo, mostraram que a vitamina D 3 diminuía o peso corporal em galinhas, mesmo em níveis que não eram suficientes para eliminar completamente o raquitismo. enquanto a vitamina A eliminou esse efeito. Eles também mostraram que altos níveis de vitamina D diminuíram os estoques de vitamina A no fígado e reduziram o nível de vitamina A no sangue. 39 O fato de a vitamina A antagonizar alguns dos efeitos da vitamina D não é mais uma razão para evitar a vitamina A do que o fato de a vitamina D antagonizar algumas das ações da vitamina A é uma razão para evitar a vitamina D. A vitamina A tem uma gama muito ampla de benefícios positivos e por si só permite que alguns dos benefícios da vitamina D ocorram. Todas as pesquisas sugerem que os benefícios à saúde são maximizados pelo fornecimento de ambas as vitaminas importantes – algo alcançado, por exemplo, com as dietas tradicionais observadas por Weston Price e suplementos alimentares importantes, como óleo de fígado de bacalhau com alto teor de vitaminas. |
| Carotenos: Nem totalmente adequado nem totalmente seguroIronicamente, a pesquisa sobre vitamina A e osteoporose, em vez de indicar a vitamina A, estabelece que nossas necessidades de vitamina A são ainda maiores do que se pensava! Os níveis de retinol sérico são considerados deficientes abaixo de 0,7 µM e geralmente considerados marginalmente deficientes em 1,05 ou 1,1 µM. Robert Russell, em uma palestra por sua aceitação do Prêmio Memorial Robert H. Herman em Nutrição Clínica, descreveu um teste mais sensível para a deficiência de vitamina A que usava a capacidade dos olhos do paciente de se adaptarem à escuridão. Esse critério mais sensível mostrou que níveis séricos de retinol de 1,4 µM são necessários para garantir a suficiência. 52 O risco de fratura fornece uma medida ainda mais sensível da deficiência de vitamina A. Michaelsson, Melhus e outros descobriram que o menor risco de fratura de quadril em residentes com deficiência de vitamina D em Uppsala, Suécia, é encontrado entre os pacientes com um nível sérico de vitamina A de 2,17-2,36 µM. 11 A equipe de Opotowski forneceu uma curva em forma de U muito mais limpa e perfeita para os níveis séricos de vitamina A, onde os quintis mais baixos e mais altos tinham o dobro do risco de fratura, assim como o quintil do meio, onde os níveis de vitamina A estavam entre 1,9 e 2,13 µM. 12 Esses estudos sugerem que os níveis de vitamina A anteriormente considerados suficientes são, na verdade, inadequados para fornecer proteção ao sistema esquelético. Na verdade, pode muito bem ser que, com níveis ideais de vitamina D, o nível ideal de vitamina A seja ainda mais alto. À luz do aumento da necessidade de vitamina A que esses estudos mostram, devemos retornar à questão: os carotenos de alimentos vegetais podem fornecer níveis ideais de vitamina A? Carotenos: não é uma fonte adequada de vitamina APesquisas desde a década de 1990 têm questionado suposições anteriores sobre a adequação dos carotenos encontrados em alimentos vegetais como fonte de vitamina A. Em 1949, Hume e Krebs induziram com sucesso a deficiência de vitamina A em três de 16 seres humanos após 12 meses de dieta de depleção. Os pesquisadores trataram com sucesso um sujeito com retinol e trataram com sucesso os outros dois com uma dose concentrada de carotenos dissolvidos em óleo que era cerca de quatro vezes maior que a dose de retinol, levando-os a estabelecer que 3,8 unidades de caroteno são iguais a uma unidade de retinol. Uma equipe de pesquisadores liderada por Sauberlich realizou um experimento semelhante em 1974, estabelecendo um fator de conversão de duas unidades de caroteno dissolvido em óleo para cada unidade de retinol. 53 Vários outros experimentos na época estabeleceram fatores de conversão entre dois e quatro para carotenos dissolvidos em óleo também. 54 A Organização para a Alimentação e Agricultura (FAO) e a Organização Mundial da Saúde (OMS) divulgaram uma recomendação conjunta em 1967 de que seis unidades de carotenos deveriam ser consideradas equivalentes a uma unidade de retinol, recomendação que renovaram inalterada em 1988. Isso levou HP Oomen, a proeminente pesquisador que primeiro destacou o problema da deficiência de vitamina A no terceiro mundo, a escrever: “Todo o procedimento de distribuição da vitamina seria totalmente supérfluo se o caroteno adequado estivesse presente na dieta das crianças.” Oomen acreditava que apenas 30 gramas por dia de vegetais de folhas verdes escuras seriam suficientes por si só para fornecer vitamina A adequada para crianças desnutridas. 54 Ainda assim, na década de 1990, as coisas começaram a mudar. Suharno e outros observaram em 1994 que mulheres grávidas indonésias consumiam carotenos suficientes para produzir três vezes a quantidade recomendada de vitamina A com base no fator de conversão da OMS, embora um grande número delas sofresse de deficiência marginal de vitamina A. Estudos de intervenção subsequentes direcionados a crianças em idade escolar e mulheres que amamentam no Vietnã descobriram que o fator de conversão para carotenos em vegetais era 26 e 28, respectivamente, e 12 quando os carotenos eram consumidos em frutas. Em 2002, o Instituto de Medicina dos EUA (IOM) estabeleceu uma taxa de conversão de 12 para ß-caroteno, 24 para outros carotenos com atividade de vitamina A e dois para carotenos dissolvidos em óleo. West e outros criticaram o uso seletivo de estudos empregados pelo IOM,54Em 2003, Tang e seus colegas mostraram que até mesmo a eficiência do ß-caroteno dissolvido no óleo havia sido superestimada. Os pesquisadores deram uma dose concentrada de ß-caroteno radiomarcado dissolvido em óleo para 22 voluntários adultos e rastrearam a conversão de ß-caroteno em vitamina A que ocorreu tanto no intestino quanto após a absorção intestinal. A taxa de conversão total média para o caroteno solúvel em óleo neste experimento foi de 9,1, e as taxas individuais variaram de 2,4 a 20,2. 53 Os defensores dos carotenos como fonte ideal de vitamina A afirmam que o corpo só converte os carotenos em vitamina A “conforme a necessidade” e que quando os estoques de vitamina A são altos, o corpo não converte os carotenos em vitamina A desnecessária. Parece que se o status de vitamina A for adequado, o corpo dificilmente converterá qualquer caroteno em vitamina A, mesmo se administrado por imersão em óleo. Por exemplo, um estudo controlado administrou cerca de 120.000 UI de ß-caroteno como uma imersão em óleo a oito homens com níveis médios de retinol sérico de 2,47 µM e a 21 mulheres com níveis médios de retinol sérico de 2,11 µM todos os dias durante seis meses. No final do estudo, os indivíduos que tomaram o ß-caroteno à base de óleo tinham seis vezes a concentração de ß-caroteno em seu tecido adiposo e oito vezes a concentração de ß-caroteno em seu sangue,55 Outro fator que afeta a taxa de conversão de caroteno é a infecção parasitária, que diminui a capacidade do corpo de utilizar carotenos. 56 Um estudo sobre os efeitos dos carotenos no retinol plasmático em escolares da Guatemala descobriu que até 71% das crianças estudadas estavam infectadas com qualquer parasita, 57 e autores de outros estudos levantaram preocupações de que as infecções parasitárias podem ter contribuído para a conversão deficiente de carotenos à vitamina A entre alguns indivíduos em seus próprios estudos. 56 Nossa questão, então, é se os carotenos, quando administrados a indivíduos com funcionamento intestinal saudável e sem infecções parasitárias, podem trazer baixos níveis de vitamina A até os níveis ideais de cerca de 2,0 µM que parecem otimizar a saúde esquelética. Tang e colegas conduziram um experimento 58com alunos chineses que respondem a esta pergunta. Os pesquisadores trataram as crianças com parasitas antes do estudo e verificaram que todas estavam livres do parasita no início do estudo. Eles alimentaram uma dieta rica em vegetais com alto teor de caroteno, rendendo cerca de 16.000 UI de ß-caroteno por dia, para uma classe do jardim de infância e uma dieta rica em vegetais com baixo teor de caroteno, rendendo cerca de 2.000 UI de ß-caroteno por dia, para outro, enquanto ambos os grupos comeram cerca de 700 UI de retinol pré-formado de carne e ovos por dia, durante dez semanas. A concentração média de retinol sérico do grupo com alto teor de caroteno aumentou de 1,05 µM para 1,12 µM, mas a diferença não foi estatisticamente significativa. Na verdade, alguns níveis de retinol sérico no grupo realmente diminuíram, um até 0,72 µM!O grupo com baixo teor de caroteno, por outro lado, experimentou uma diminuição estatisticamente significativa nos níveis médios de retinol sérico de 1,24 µM para 0,98 µM. A classe com baixo teor de caroteno havia realmente iniciado o estudo com estoques de fígado e níveis de retinol sérico substancialmente maiores do que o grupo com alto teor de caroteno. Enquanto as reservas de armazenamento de vitamina A do grupo com alto teor de caroteno permaneceram inalteradas, o grupo com baixo teor de caroteno consumiu quase 26.000 UI de vitamina A armazenada, embora o armazenamento corporal total médio de vitamina A no grupo com baixo teor de caroteno, 100 µM, permanecesse superior ao do alto caroteno, 94 µM, no final do estudo. Este estudo demonstrou um fator de conversão de 27 unidades de caroteno para igualar uma unidade de retinol. Mesmo que todos os indivíduos tivessem níveis de retinol sérico não apenas abaixo daqueles que se mostraram ideais para a saúde do esqueleto, mas também abaixo daqueles que garantiam proteção contra anormalidades de adaptação ao escuro (1,4 µM), e alguns níveis de retinol de alguns indivíduos beiravam a deficiência evidente (0,7 µM) a maior taxa de conversão individual foi de 19 unidades de caroteno para cada unidade de retinol, enquanto a taxa de conversão menos eficiente foi de 48 unidades de caroteno para cada unidade de retinol. Se os carotenos são convertidos em vitamina A “conforme a necessidade”, seria de se esperar que as crianças deficientes em vitamina A os convertessem a uma taxa maior do que 19 para 1. Na verdade, como o grupo com baixo teor de caroteno começou com estoques de vitamina A consideravelmente maiores no fígado, o estudo pode ter superestimado o valor dos vegetais com alto teor de caroteno como fonte de vitamina A. Os níveis de vitamina A tanto no fígado quanto no soro são dinâmicos. Altos níveis de vitamina A no fígado e no sangue não ficam apenas esperando para serem usados. A vitamina A que circula no sangue é usada constantemente, cada molécula frequentemente sendo reciclada sete a nove vezes antes de ser irreversivelmente perdida. Quanto maiores os estoques de vitamina A no fígado, mais rapidamente a vitamina A no sangue é distribuída aos tecidos periféricos e utilizada. Altas reservas de fígado podem fazer com que a vitamina A seja utilizada 10 vezes mais rápido do que quando as reservas de fígado estão baixas. 59,60 Assim, como os autores do estudo sugeriram, os maiores estoques de fígado das crianças no grupo de baixo caroteno, que ainda eram maiores do que os estoques de fígado do grupo de alto caroteno mesmo no final do estudo de 10 semanas, provavelmente contribuíram para taxas de utilização significativamente mais altas de vitamina A armazenada. Portanto, os membros do grupo com alto teor de caroteno mantiveram seus baixos estoques de vitamina A no fígado não apenas porque consumiram vegetais ricos em caroteno, mas também porque seus corpos usaram a vitamina A em um ritmo muito mais lento . Os vegetais com alto teor de caroteno, portanto, eram provavelmente consideravelmente menos úteis na manutenção do status de vitamina A do que pareciam.Se doses concentradas de ß-caroteno fossem administradas a essas crianças livres de parasitas com níveis relativamente baixos de vitamina A, elas poderiam ter aumentado o retinol sérico de maneira mais eficaz para níveis ideais? É possível – ainda outra pesquisa sugere fortemente que manter os níveis de retinol sérico por meio de altas doses de carotenos pode realmente ser prejudicial à saúde. Carotenos: não são tão seguros quanto parecem ser rachadosEspecialistas em saúde que alertam sobre os supostos perigos do retinol pré-formado afirmam universalmente que os carotenos de alimentos vegetais são seguros. Na verdade, os carotenos só são “seguros” em relação à osteoporose na medida em que são inúteis como fonte de vitamina A. O primeiro experimento mostrando altas doses de vitamina A para interferir na capacidade da vitamina D de tratar o raquitismo foi realizado com vacas e usado carotenos de volumoso. Estudos que mostram uma relação entre a vitamina A e a osteoporose em humanos mostram de fato que os carotenos são inofensivos – e geralmente os autores reconhecem que isso ocorre porque os carotenos são ineficazes em elevar os níveis de retinol sérico. A ideia de que os carotenos são totalmente seguros é, no entanto, muito errada. O ß-caroteno não só pode ser convertido em vitamina A, mas também pode ser convertido em uma série de “produtos de clivagem excêntricos” potencialmente prejudiciais dentro da célula. Quando a gordura poliinsaturada, ácido linoléico, é adicionada à mistura, a produção desses produtos de clivagem excêntrica aumenta dramaticamente. Esses produtos podem induzir a ligação do carcinógeno transmitido pela fumaça, benzo [a] pireno, ao DNA, e pesquisas sugerem que eles podem realmente interferir na atividade da vitamina A. 52 Na década de 1990, os pesquisadores realizaram dois ensaios de intervenção para testar o efeito da suplementação de ß-caroteno em fumantes e trabalhadores expostos ao amianto, ambos descobrindo que o ß-caroteno aumenta o risco de câncer de pulmão. Os pesquisadores responderam a esta descoberta estudando o efeito do ß-caroteno e da fumaça do cigarro em furões. Enquanto os furões expostos ao tratamento combinado de ß-caroteno e fumaça de cigarro exibiram a maior magnitude de alterações pré-cancerosas, o ß-caroteno sozinho também causou alterações pré-cancerosas substanciais. ß-caroteno também deprimidoo nível de vitamina A ativada nos tecidos pulmonares dos ferrets, mesmo na ausência de fumaça; na presença de fumaça, aumentou a expressão do complexo AP-1, que promove câncer. A vitamina A inibe a expressão do complexo AP-1, o que significa que o ß-caroteno parece promover o câncer ao induzir uma deficiência local de vitamina A em certos tecidos. 52 Esta pesquisa deve enviar uma onda de dúvidas sobre o valor do ß-caroteno como fonte de vitamina A para a comunidade de pesquisa e o público. O próprio fato de ß-caroteno, apesar de ser capaz de aumentar os níveis de vitamina A no sangue em algum grau em pessoas com deficiência de vitamina A, pode diminuirOs níveis de vitamina A ativados em tecidos específicos significam que a vitamina A derivada do ß-caroteno pode ser, em alguns tecidos, pior do que inútil. Robert Russell sugeriu em sua palestra premiada que os produtos de clivagem excêntrica que são produzidos a partir de ß-caroteno sob condições de estresse oxidativo podem interferir com a vitamina A induzindo sua destruição pelas enzimas do citocromo P450.52 Curiosamente, este é o mesmo mecanismo pelo qual dioxinas causam câncer em alguns tecidos, e por que a vitamina A previne o câncer induzido por dioxinas.45 Ambos os ácidos graxos essenciais ômega-6 e ômega-3 são poliinsaturados e, portanto, contêm várias ligações duplas que os tornam sujeitos à oxidação. O ácido linoléico ômega-6 e a fumaça do cigarro mostraram aumentar drasticamente a produção de produtos de clivagem excêntrica do ß-caroteno que empobrecem os tecidos de vitamina A. Na verdade, todos os óleos poliinsaturados que foram testados, mesmo quando frescos, aumentam a níveis de estresse oxidativo no corpo, com exceção do óleo de fígado de bacalhau, cujo alto teor de vitamina A pré-formada protege seus ácidos graxos poliinsaturados da oxidação, uma vez que são incorporados às membranas celulares. 45 Por outro lado, substituir ß-caroteno e óleo de peixe por óleo de fígado de bacalhau rico em vitamina A, em vez de proteger esses ácidos graxos, causaria uma combinação potente de estresse oxidativo e altos níveis de carotenos, produzindo compostos nocivos que destroem a vitamina A e prejudicam a saúde e contribuir para o câncer. Os defensores da obtenção de vitamina A principalmente do ß-caroteno argumentam que o consumo de grandes quantidades de retinol anula a sabedoria natural do corpo, que regula os níveis de vitamina A convertendo os carotenos em vitamina A apenas “conforme a necessidade”. No entanto, o precedente nas dietas tradicionais não são grandes quantidades de carotenos e baixas quantidades de retinol. Weston Price e outros exploradores demonstraram que grupos pré-modernos comiam dietas ricas em retinol e valorizavam alimentos ricos em retinol, como carnes orgânicas, como promotores de saúde. Por outro lado, o corpo descarta a maior porção de carotenos que encontra nos alimentos vegetais: apenas cerca de 12% dos carotenos nos brócolis são absorvidos e apenas cerca de 18% dos carotenos nas cenouras são absorvidos. 54 A ingestão de doses concentradas de carotenos dissolvidos em óleo anula essa “sabedoria natural” do corpo?O único alimento que pode oferecer um precedente tradicional para grandes doses de carotenos dissolvidos em óleo é o óleo de palma vermelho. Em dietas tradicionais que não incluem óleo de palma vermelho, os carotenos seriam obtidos principalmente de frutas e vegetais, dos quais são mal absorvidos. Pode ser o caso que consumir quantidades substanciais de retinol permitiria tirar vantagem dos muitos benefícios à saúde conferidos por quantidades razoáveis de carotenos enquanto também protegia contra a depleção de vitamina A que os carotenos induzem em alguns tecidos. Consumir alimentos como o óleo de palma vermelha no contexto de uma dieta completa incluindo retinol substancial pode, então, ser muito benéfico; não há, entretanto, precedente para um grupo cuja saúde rivaliza com os grupos não modernizados estudados por Weston Price, que consomem grandes quantidades de carotenos e quantidades mínimas de retinol. |
Das Vitaminas aos Alimentos
A falha fatal da teoria de que a vitamina A causa a osteoporose é paradigmática: a abordagem geral da nutrição que vê as vitaminas como substâncias químicas isoladas agindo no vácuo, em vez de alimentos – associações grandiosas e complexas de muitas substâncias químicas que agem em conjunto – só pode dê tantos frutos antes de vacilar.
O reducionismo de fato tem seu lugar. Há verdadeiro valor em realizar experimentos para ver quais efeitos podemos atribuir à vitamina A e quais podemos atribuir à vitamina D.
A completa tolice, no entanto, de concluir que, porque a vitamina A “antagoniza” a vitamina D, devemos evitá-la, é revelado na história da descoberta das vitaminas.
A primeira cura para o raquitismo não era a vitamina D.
A primeira cura para o raquitismo era um alimento: óleo de fígado de bacalhau.
O óleo de fígado de bacalhau foi inicialmente usado como agente terapêutico na década de 1770 e, em meados do século XIX, era bem conhecido como uma cura para o raquitismo, a osteomalácia, a desnutrição geral e várias doenças oculares. 61
A vitamina A foi descoberta pela primeira vez em 1913 como um componente do óleo de fígado de bacalhau e da gordura da manteiga.
Embora a vitamina A esteja presente no óleo de fígado de bacalhau em concentrações 10 a 25 vezes maiores do que seu suposto inimigo, a vitamina D, o óleo de fígado de bacalhau era uma cura tão eficaz para o raquitismo que o médico britânico Sir Edward Mellanby atribuiu as propriedades anti-raquíticas do óleo de fígado de bacalhau à sua vitamina A. 33
Em 1921, entretanto, Shipley, Park, McCollum e Simmonds publicaram um artigo marcante demonstrando que a gordura da manteiga, fornecida como 5% da dieta, não era suficiente para tratar o raquitismo, ao contrário de doses menores de óleo de fígado de bacalhau. 62
(Deve-se ter em mente que mesmo a manteiga alimentada com capim é muito pobre em vitamina D durante um “inverno de vitamina D”, ou quando as vacas são alimentadas com capim dentro de casa.)
Este foi o primeiro artigo sugerindo que o fator que tratou a xeroftalmia – um doença ocular causada por deficiência de vitamina A – era um fator distinto daquele que tratava o raquitismo, devido à sua distribuição diferente entre os alimentos.
Em 1922, os mesmos pesquisadores mostraram que o óleo de fígado de bacalhau aerado à temperatura de água fervente por 12 a 20 horas manteve sua propriedade antirraquítica, mas perdeu sua eficácia contra a xeroftalmia, confirmando a identidade separada desses dois fatores, o segundo dos quais veio a ser conhecido como vitamina D.
No entanto, o óleo de fígado de bacalhau foi eficaz contra doenças de deficiência de vitamina A e deficiência de vitamina D. As duas vitaminas não se cancelavam e não se cancelam.
Podemos ver um fenômeno semelhante na maneira como Weston Price demonstrou a alta atividade anti-raquítica de seu óleo de manteiga com alto teor de vitaminas.
Ele alimentou dois ratos com uma dieta deficiente em cálcio e fósforo e fortificou a dieta de um deles com óleo de manteiga.
O último rato não só se recuperou de raquitismo, mas experimentou um aumento simultâneo em ambos os níveis séricos de cálcio e fósforo – um efeito de vários compostos que trabalham em conjunto no interior do veículo de uma única alimentação. 63
Comer alimentos integrais, entretanto, não é suficiente. Os chamados “primitivos” estudados por Weston Price adaptaram dietas e estilos de vida completos para atender às suas necessidades. A
limentos ricos em um nutriente e pobres em outro foram combinados em uma dieta que, como um todo, produziu as grandes quantidades de minerais e vitaminas que Price documentou.
Assim, a descoberta de que os participantes do Estudo de Saúde das Enfermeiras que comiam fígado regularmente – um alimento tradicional integral – tinham um risco aumentado de fratura é, na verdade, consistente com as descobertas de Price.
Por si só, o fígado de animais terrestres, especialmente ruminantes como gado e cordeiro, é muito rico em vitamina A, 64 enquanto os fígados de ruminantes e de aves têm apenas cerca de 12 UI de vitamina D para cada 100 gramas. 65
O óleo de fígado de bacalhau, por outro lado, é rico em vitaminas A e D.
Na verdade, o óleo de fígado de bacalhau com alto teor de vitaminas, usado por Price, não só contém mais do que o dobro da quantidade de vitamina A, mas também contém quase seis. vezes a quantidade de vitamina D que o óleo de fígado de bacalhau normal, reduzindo a proporção de vitamina A para D de 25 para 1 para 10 para 1, e pode fornecer 4.000 UI de vitamina D em pouco mais de uma colher de sopa. 66,67
Na Noruega, onde o inverno de vitamina D é longo, muitas aldeias tradicionais do litoral ainda consomem um prato chamado molje , que é feito de fígado de peixe e óleo de fígado de peixe, bacalhau ou escamudo, dependendo da estação.
Embora os fígados de peixes sejam muito ricos em vitamina A, uma refeição típica de moljefornecerá pouco menos de 3.000 UI de vitamina D, enquanto as pessoas com maior apetite podem consumir quase 6.000 UI de vitamina D em uma única refeição. 68
Faz sentido, então, que o óleo de fígado de bacalhau com alto teor de vitaminas deve servir como um suprimento autônomo seguro de vitamina A, mesmo durante o inverno, enquanto o fígado de animais terrestres deve ser usado durante as estações em que o suprimento de raios UV-B do sol é rico o suficiente para garantir a vitamina D adequada, ou em conjunto com alimentos ricos em vitamina D, como banha de porco pastando, peixes oleosos, mariscos e gemas de ovo de galinhas pastando, todos os quais fornecem quantidades menores, mas substanciais de vitamina D.
Os principais nutrientes, como vitaminas A e D, cálcio e fósforo, não são o fim do horizonte da osteoporose.
Estudos sugerem um papel para nutrientes secundários e metais traço, incluindo zinco, vitamina B 12 , folato, boro, silício, manganês, zinco e cobre. 69 Em Soil, Grass, and Cancer , Andre Voisin escreveu sobre o gado que pastava nos Everglades em solo com deficiência de cobre.
Apesar de cálcio e fósforo suficientes na dieta, esses bovinos desenvolveram raquitismo e osteomalácia, o que foi remediado com o fornecimento de cobre na dieta. 70
Da mesma forma, Robert Becker descreveu seus próprios experimentos em The Body Electricque sugere que o cobre é a cola que mantém os cristais de hidroxiapatita – sais de cálcio e fósforo – na matriz de colágeno do osso. 71
As populações saudáveis estudadas por Weston Price não apenas comiam combinações de alimentos que proporcionavam nutrição ideal, mas também se engajavam em práticas específicas para manter a fertilidade de seu solo, o que garantiria o fornecimento desses metais traço além dos principais nutrientes.
Na verdade, Price considerava a fertilidade do solo um fator tão importante para a saúde das populações indígenas que estudou que convidou o prolífico cientista do solo, William Albrecht, para escrever o segundo capítulo do suplemento de Nutrição e Degeneração Física intitulado “Alimentos são fabricados Fertilidade do solo ”- o único capítulo deste livro épico que foi escrito por alguém além de Price.
É tão importante, então, buscar alimentos produzidos por métodos agrícolas projetados para produzir safras nutritivas, em vez de rendimentos elevados, quanto buscar os tipos certos de alimentos.
Além disso, à medida que os solos são perdidos devido ao escoamento superficial, eventualmente drenando para o mar, torna-se cada vez mais importante enfatizar os alimentos do mar em nossa dieta, como sal marinho não refinado, peixes, crustáceos e vegetais do mar, que são cultivados em regiões cada vez mais “Solos” do oceano.
É, então, um paradigma holístico que faz uma pausa e se afasta da minúcia por um momento para ver o quadro geral – em que a vitamina A é apenas uma parte de uma dieta rica em nutrientes – que é capaz de realmente avançar nossa compreensão de como conseguir saúde.
Quando a vitamina A é divorciada dessa abordagem completa à saúde, adicionada a produtos lácteos em terras há muito eclipsadas pelos invernos de vitamina D, consumida como fígado na ausência de outros alimentos que uma dieta tradicional forneceria para o equilíbrio, ou dada aos animais em doses amplamente desproporcional aos outros nutrientes que os animais encontrariam em suas dietas naturais, ele realmente contribui para a degeneração da saúde óssea.
No entanto, como Price documentou, os exemplos mais excelentes de saúde esquelética vibrante são as populações que comem dietas muito ricas em vitamina A pré-formada.
Apêndice 1: Vitaminas A e D ajudam a regular a remodelação óssea
A forma ativada da vitamina A, ácido retinóico (AR), e a forma ativada da vitamina D, calcitriol, são ambos hormônios.
Um hormônio é uma substância química que realiza várias funções de sinalização celular ligando-se primeiro a um receptor e, assim, causando uma mudança na forma desse receptor, que por sua vez faz com que o receptor inicie uma cascata de enzimas e outras moléculas de sinalização que transportam algum efeito direto na célula, ou mover-se para o núcleo onde, geralmente complexado com uma ou mais outras moléculas, se liga a partes específicas de genes e faz com que alterem sua expressão – para ligá-los, desligá-los, desligá-los aumentá-los ou diminuí-los.
O efeito de qualquer hormônio pode variar amplamente entre diferentes células e tecidos,
A vitamina A ativada deve se ligar a um de pelo menos três receptores chamados receptores de ácido retinóico (RARs) para realizar sua função.
Depois de se ligar a um RAR, essas duas moléculas juntas devem se ligar a um receptor de retinoide X (RXR), após o qual este complexo triplo se liga a partes específicas de genes específicos chamados “elementos de resposta de ácido retinoide” (RAREs), e então prossegue para alterar a expressão de genes específicos, que são referidos como “genes alvo” do ácido retinóico. 6
Da mesma forma, a vitamina D ativada deve se ligar ao receptor da vitamina D (VDR) e, subsequentemente, complexar com um RXR a fim de se ligar aos elementos de resposta à vitamina D (DREs) e alterar a expressão dos genes-alvo da vitamina D. 6
Ambos os osteoblastos 72,73 e os osteoclastos 6 contêm tanto RARs quanto VDR; assim, as vitaminas A e D regulam a atividade dos osteoblastos e dos osteoclastos.
Em alguns casos, seu efeito regulador envolve interações entre as vitaminas e seus respectivos receptores nas células ósseas reais.
De outras maneiras, as vitaminas modificam a remodelação óssea indiretamente, afetando a homeostase mineral. 28
O processo de remodelação óssea envolve um sinergismo entre osteoblastos e osteoclastos, onde os dois se regulam.
O processo de remodelação óssea é iniciado quando os osteoblastos imaturos secretam o receptor ativador do fator nuclear-kB ligante (RANKL), que se liga ao receptor ativador do nuclear fator-kB (RANK), um receptor na superfície das células precursoras dos osteoclastos, ativando-as para amadurecem em osteoclastos e começam a erodir os ossos.
À medida que os osteoclastos erodem o osso, o osso erodido libera sinais de fator de crescimento, como o fator de crescimento semelhante à insulina-1 (IGF-1) e o fator de crescimento transformador-ß (TGF-ß) que estimulam a maturação dos osteoblastos.
Conforme os osteoblastos amadurecem, eles secretam progressivamente menos RANKL e começam a secretar osteoprotegrina (OPG), que se liga ao receptor RANK e impede que RANKL o ative.6
A vitamina A ativada aumenta a reabsorção óssea, aumentando a expressão de RANKL e diminuindo a expressão de OPG.
A taxa de reabsorção óssea é determinada pela proporção de RANKL, que ativa RANK, para OPG, que inibe competitivamente RANKL de ativar RANK. 6
Os estudos geralmente mostram que o efeito dominante da vitamina A é promover a reabsorção óssea, enquanto o efeito dominante da vitamina D é inibir a reabsorção óssea.
Um estudo mostrou, entretanto, que a vitamina A pode inibir a reabsorção óssea; 6 da mesma forma, a vitamina D é necessária para a reabsorção óssea, que promove indiretamente, aumentando a absorção de cálcio e fósforo no intestino. 28
A vitamina A também pode contribuir para o crescimento ósseo, elevando o nível dos fatores de crescimento, que ativam os osteoblastos. 12
Embora possa parecer confuso que a vitamina A e a vitamina D exerçam ações opostas, outras substâncias químicas também têm papéis conflitantes na regulação da remodelação óssea.
Por exemplo, a leptina – agora se tornando popularmente conhecida como regulador do apetite – foi descoberta pela primeira vez como um indutor da reabsorção óssea produzida por células nervosas, mas também pode ser secretada pelo próprio tecido ósseo como um indutor do crescimento ósseo.6
Desde a reabsorção óssea e o crescimento é, de certa forma, processos antagônicos, mas, no entanto, processos complementares que fazem parte do mesmo sistema e se regulam sinergicamente, não é surpreendente que os vários fatores externos que afetam essa regulação possam ter papéis conflitantes.
A loucura da alegação de que uma ou outra das vitaminas é ruim porque antagoniza a outra é revelada pelo fato de que, nas formas descritas acima, a vitamina A na verdade “antagoniza” a própria vitamina A, e a vitamina D na verdade “antagoniza” a vitamina O próprio D!
Apêndice 2: A vitamina A “interfere” na vitamina D?
Várias sugestões foram feitas sobre os possíveis mecanismos pelos quais a vitamina A pode interferir com a função da vitamina D: 6
- Depois que cada vitamina ativada se liga a seu respectivo receptor, cada uma deve se ligar a um segundo receptor chamado “receptor do retinóide X” (RXR). Uma vez que as vitaminas A e D devem se ligar ao mesmo receptor secundário, a vitamina A poderia inibir competitivamente a ligação da vitamina D ao RXR.
- A forma ativa da vitamina A, o ácido retinóico, pode induzir a expressão da enzima 24-OH-hidroxilase, que causa a inativação da vitamina D.
- As vitaminas A e D podem competir pela absorção no intestino.
Um estudo mostrou que o RXR é insuficiente em um determinado tipo de célula hipofisária para que as vitaminas A e D possam inibir-se competitivamente, mas outro estudo mostrou que o RXR é fornecido abundantemente nas células da medula óssea e que isso é não é um mecanismo de competição pelas duas vitaminas na medula óssea. 74
Nenhum estudo demonstrou esse tipo de competição em células ósseas ou intestinais.
Embora dois estudos tenham descoberto que a vitamina A ativada induziu a expressão da enzima 24-OH-hidroxilase em camundongos após oito e 18 horas, um estudo mostrou que este é simplesmente um fluxo temporário e que a diminuição subsequente da vitamina D ativada na verdade deprime 24 -OH-hidroxilase a longo prazo.
As vitaminas A e D têm o mesmo efeito interativo sobre os níveis séricos de cálcio e fósforo, mesmo quando a forma de vitamina D usada é um isômero sintético que não pode ser destruído pela enzima 24-OH-hidroxilase, indicando que esse efeito não tem nada a ver com a vitamina Um incentivo à inativação da vitamina D. 34
Um estudo mostrou que altos níveis de vitamina D diminuíram os estoques de vitamina A no fígado e reduziram o nível de vitamina A no sangue. 39
Os pesquisadores sugeriram que a vitamina D estava impedindo a vitamina A de ser absorvida e transportada no intestino, mas sem analisar a perda fecal de vitamina A, eles não tinham como mostrar que qualquer “interferência” estava ocorrendo.
Outra possibilidade poderia ser que a alta atividade da vitamina D estivesse induzindo a entrega de vitamina A aos tecidos, a fim de ser utilizada em processos cooperativos que requerem ambas as vitaminas.
Isso é corroborado por um estudo publicado anteriormente pelos mesmos autores, 37 em que a exposição de galinhas à luz ultravioleta – que produz vitamina D que não precisa ser transportada do intestino para o sangue – reduziu os estoques hepáticos e os níveis de vitamina A.
Da mesma forma, Johansson e Melhus descobriram que as vitaminas A e D tinham efeitos antagônicos nos níveis séricos de cálcio em humanos, mas que a quantidade de uma vitamina absorvida não parecia ser afetada pela administração da outra vitamina. 27
Por outro lado, existem exemplos em que uma vitamina pode realmente interferir na função da outra vitamina.
Por exemplo, as células-tronco da medula óssea podem se diferenciar em (transformar-se em) células granulocíticas ou monocíticas, que são dois tipos diferentes de glóbulos brancos.
Em um tipo específico de célula da medula óssea, o ácido retinóico induz a diferenciação granulocítica, enquanto o calcitriol induz a diferenciação monocítica.
O calcitriol exerce um efeito negativo dominante sobre o ácido retinóico nesta célula, o que significa que o calcitriol inibe a ação do ácido retinóico, mas o ácido retinóico não inibe o efeito do calcitriol.
Nesse caso, parte do mecanismo pelo qual o calcitriol atua é realmente eliminar a vitamina A e seu receptor do gene ao qual está se ligando.
Em outros tipos de células da medula óssea, no entanto,74 e nas células da medula óssea da leucemia, a vitamina D aumenta o efeito da vitamina A na indução de um tipo específico de diferenciação, mas não tem ação por si mesma. 50
Embora existam alguns casos em que uma vitamina pode interferir com outra, isso só é verdade em certos tipos de células em que a célula evoluiu aquele tipo específico de processo regulatório.
Em outros casos, uma vitamina pode potencializar a ação da outra, ou mesmo requerer a presença da outra para cumprir sua função.
Não devemos questionar a complexa maquinaria molecular da célula que é projetada para designar funções para cada vitamina específica daquela célula, funções que variam e não podem ser generalizadas de célula para célula e de tecido para tecido.
Com relação à osteoporose, não parece que o aparente “antagonismo” entre as vitaminas A e D envolva qualquer tipo de “interferência” molecular entre as duas vitaminas.
Apêndice 3: Fontes alimentares de vitamina D 65
| Óleo de fígado de bacalhau Banha (gordura de porco) Arenque do Atlântico (em conserva) Ostras orientais (no vapor) Bagre (cozido no vapor / escalfado) Sardinhas sem pele (embaladas em água) Cavala (enlatado / drenado) Salmão chinook defumado Esturjão camarão ova (enlatado / drenado) Gema de ovo ( Fresco) (Uma gema contém cerca de 24 UI) Manteiga Fígado de Cordeiro (Assado) Carne Sebo Fígado de Porco (Assado) Fígado de Carne (Frito) Tripas de Carne (Cru) Rim de Carne (Fervido) Fígados de Frango (Fervido) Pequenos Amêijoas (Cozido / Cozido no Vapor Húmido ) Caranguejo Azul (Cozido no Vapor) Lagostins / Lagostins (No Vapor) Lagosta do Norte (No Vapor) | 10,000 2,800 680 642 500 480 450 320 232 172 14856 20 19 12 12 12 12 12 8 4 4 4 |
Referências
- Price, Weston A., Nutrition and Physical Degeneration , publicado pelo próprio, (1945) p. 275.
- Nieves, et al., “Primary Osteoporosis”, em Coe and Favus, eds., Disorders of Bone and Mineral Metabolism , Philadelphia: Lippincott Williams e Wilkins, (2002) p. 805.
- Solomons, Noel, “Vitamina A e seu papel na nutrição e saúde das crianças”, Wise Traditions 2005 , 12 de novembro de 2005 (palestra).
- Cannel, John, “The Vitamin D Newsletter: Questions and Answers,” http://www.cholecalciferol-council.com/1_06_newsletter.pdf Publicado em janeiro de 2006. Acessado em 22 de janeiro de 2006.
- Conselho de Nutrição Responsável, “CRN Reafirma os Níveis de Ingestão de Vitamina A como Seguros e Benéficos: Urge Apoio Contínuo da Política de Limites Superiores da IOM,” http://www.crnusa.org/Shellnr010102.html Publicado em 1 de janeiro de 2002. Acessado em 2 de janeiro , 2005.
- Johansson, Sara, “Vitamin A and Osteoporosis: Experimental and Clinical Studies,” Acta Universitatis Upsaliensis. Resumos abrangentes de dissertações de Uppsala da Faculdade de Medicina , 1392 (2004) 65 pp.
- Melhus, et al., “Excessive Dietary Intake of Vitamin A is Associated with Reduced Bone Mineral Density and Aumented Risk for Hip Fracture”, Annals of Internal Medicine , Vol. 129 No. 10 (1998) 770-778.
- Ballew, et al., “High Serum Retinyl Esters are not Associated with Reduced Bone Mineral Density in the Third National Health and Nutrition Examination Survey, 1988-1994” Journal of Bone and Mineral Research , Vol. 16 No. 12 (2001) p. 2306.
- Feskanich, “Vitamina A e fraturas de quadril entre mulheres pós-menopáusicas”, Journal of the American Medical Association , Vol. 287 No. 1 (2002) 47-54.
- Promislow et al., “Retinol Intake and Bone Mineral Density in the Elderly: The Rancho Bernardo Study,” Journal of Bone and Mineral Research , Vol. 17 No. 8 (2002) 1349-58.
- Michaelsson et al., “Níveis de Retinol no Soro e o Risco de Fratura”, New England Journal of Medicine , 348 (2003) 287-94.
- Opotowsky, et al., “Concentração de vitamina A no soro e o risco de fratura de quadril entre mulheres de 50 a 74 anos de idade nos Estados Unidos: uma análise prospectiva do estudo de acompanhamento NHANES I”, The American Journal of Medicine , 117 ( 2004) 169-174.
- Lim et al., “A ingestão de vitamina A e o risco de fratura de quadril em mulheres na pós-menopausa: o Iowa Women’s Health Study,” Osteoporosis Int , 15 (2004) 552-559.
- Barker et al., “Serum Retinoids and Beta-Carotene as Predictors of Hip and Other Fractures in Elderly Women,” Journal of Bone and Mineral Research , Vol. 20 No. 6 (2005) 913.
- Myhre, et al., “As formas miscíveis em água, emulsionadas e sólidas de suplementos de retinol são mais tóxicas do que as preparações à base de óleo”, Am J Clin Nutr 78 (2003) 1152-9.
- Booth, et al., “Natural food sources of vitamin A and provitamin A,” In: Scrimshaw, ed., Food and Nutrition Bulletin , Vol. 14 No. 1., Tokyo: United Nations University (1992) http://www.unu.edu/unupress/food/8F141e/8F141E04.htm Acessado em 22 de janeiro de 2006.
- Adams e Hollis, “Vitamin D: Synthesis, Metabolism, and Clinical Measurement.” Em: Coe e Favus, eds., Disorders of Bone and Mineral Metabolism , Filadélfia: Lippincott Williams e Wilkins (2002) p. 159.
- Webb, et al., “Influência da estação e latitude na síntese cutânea de vitamina D3: a exposição à luz solar de inverno em Boston e Edmonton não promoverá a síntese de vitamina D3 na pele humana”, J Clin Endocrinol Metab , Vol. 67 No. 2 (1988) 373-8.
- Engelsen, et al., “Symposium-in-Print: UV Radiation, Vitamin D and Human Health: An Unfolding Controversy: Daily Duration of Vitamin D Synthesis in Human Skin with Relation to Latitude Total Ozone, Altitude, Ground Cover, Aerosols and Cloud Thickness, ” Photochemistry and Photobiology , 81 (2005) 1287-1290.
- Canty and Associates LLC, “Weatherbase: Historical Weather for Uppsala, Sweden,” http://www.weatherbase.com/weather/weather.php3?s=024580 Acessado em 2.2006 de janeiro
- Engelson, Ola, “Duration of Vitamin D Synthesis in Human Skin: Version 1.0” http://nadir.nilu.no/~olaeng/fastrt/VitD.html (2005) Acessado em 22 de janeiro de 2006.
- Heaney, Robert P., “O requisito de vitamina D na saúde e na doença”, Journal of Steroid Biochemistry & Molecular Biology , 97 (2005) 13-19.
- Cannel, John, “Vit D: When Why Where and How Much,” Wise Traditions 2005 12 de novembro de 2005 (palestra).
- Michaelsson, et al., “Dietary cálcio e ingestão de vitamina D em relação ao risco de fratura osteoporótica,” Bone , 32 (2003) 694-703.
- Falahati-Nini, et al., “Contribuições relativas da testosterona e estrogênio na regulação da reabsorção e formação óssea em homens idosos normais,” J Clin Invest Vol. 106 No. 12 (2000) 1553-60.
- Mauras et al., “Hormônio de crescimento, fator de crescimento semelhante à insulina I e hormônios sexuais: efeitos no metabolismo de proteínas e cálcio”, Acta Paediatr Suppl. Vol. 88 No. 433 (1999) 81-3.
- Johansson e Melhus, “Vitamin A Antagonizes Calcium Response to Vitamin D in Man,” Journal of Bone and Mineral Research , Vol. 16 No. 10 (2001) 1899.
- Amling, et al., “Rescue of the Skeletal Phenotype of Vitamin D Receptor-Ablated Mice in the Setting of Normal Mineral Ion Homeostasis: Formal Histomorphometric and Biomechanical Analyzes,” Endocrinology , Vol. 140 No. 11 (1999) 4982-4987.
- Favus, Murray J., “Intestinal Absorption of Caclium, Magnesium and Phosphorus.” Em: Coe e Favus, eds., Disorders of Bone and Mineral Metabolism: Second Edition , Philadelphia: Lippincott Williams e Wilkins (2002) 48-73.
- Masuyama, et al., “Dietary Calcium and Phosphorus Ratio Regulates Bone Mineralization and Turnover in Vitamin D Receptor Knockout Mice by Affecting Intestinal Calcium and Phosphorus Absorption,” Journal of Bone and Mineral Research , Vol. 18 No. 7 (2003) 1217.
- Nemere, et al., “Ribozyme knockdown functionally links a 1,25 (OH) 2D3 membrana binding protein (1,25 (OH) 2D3-MARRS) and phosphate uptake in intestinal cells”, Proc Natl Acad Sci USA (2004) 7392 -7397.
- Rohe, et al., “Indentification and Characterization of 1,25D3-membran-associated rapid response steroid (1,25D3-MARRS) -inding protein in rat IEC-6 cell,” Steroids , 70 (2005) 458-463.
- Rhode, et al., “Vitamin A Antagonizes the Action of Vitamin D in Rats,” J. Nutr ., 129 (1999) 2246-2250.
- Rhode e DeLuca, “All-trans Retinoic Acid Antagonizes the Action of Calciferol and Its Active Metabolite, 1,25-Dihydroxycholecalciferol, in Rats,” J Nutr , 135 (2005) 1647-1652.34.a. Armas, et al., “Vitamin D2 Is Much Less Effective than Vitamin D3 in Humans,” The Journal of Clinical Endocrinology and Metabolism , Vol. 89 No. 11 (2004) 5387-5391.
- Whitehead, et al., “Altas necessidades de vitamina D3 em frangos para qualidade óssea e prevenção de discondroplasia tibial e interações com cálcio dietético, fósforo disponível e vitamina A”, British Poultry Science , Vol. 45 No. 3 (2004) 425-436.
- O consumo médio de ração de todos os grupos da mesma raça de frangos de corte (Ross x Ross 308) durante o mesmo período de tempo (14 dias) e começando no mesmo dia de idade (um dia de idade) em um estudo separado por outros autores foi relatado como 36,2 gramas / dia. Knox, Anne, et al., “Relatório Confidencial: Teste de Frangos de Corte: Uma Comparação do Desempenho de Frangos de Corte Alimentados com Dietas à Base de Trigo, Deficientes no Conteúdo Total de Aminoácidos Contendo Enxofre (entre 8 e 10% abaixo do requisito) Com e sem o Additino de qualquer DL-Metionina ou Alimet, ”http://www.novusint.com/Public/Library/en-us/PDF/Roslin%2520Final%2520Report.pdf&e=9797, Acessado em 19 de janeiro de 2005 a estimativa de peso corporal usa os pesos finais do dia 14 fornecidos em Whitehead et al.
- Aburto e Britton, “Effects of Different Levels of Vitamins A and E on the Utilization of Cholecalciferol by Broiler Chickens,” Poultry Science , 77 (1998) 570-577.
- Usando a mesma ingestão diária de ração de Knox et al. Um pequeno erro será introduzido na estimativa porque o Knox et al. o valor se aplica à ingestão média durante os primeiros 14 dias, enquanto o estudo de Aburto e Britton durou 16 dias. O peso corporal é assumido como sendo o peso corporal de 16 dias fornecido em Aburto e Britton (1998) 570-577.
- Aburto, et al., “A influência da Vitamina A na Utilização e Melhoria da Toxicty of Cholecalciferol, 25-Hydroxycholecalciferol, and 1,25 Dihydroxycholecalciferol in Young Broiler Chickens,” Poultry Science , 77 (1998) 585-593.
- Usando a mesma ingestão diária de ração de Knox et al. A mesma margem de erro se aplica conforme observado na análise do estudo anterior. O peso corporal é assumido como sendo o peso corporal de 16 dias dado em Aburto et al. (1988) 585-593,40.a. Uma vez que IU é uma medida de atividade fisiológica, tecnicamente não deve ser usado dessa forma para medir as formas mais ativas de vitamina D. É, no entanto, usado no texto para expressar o peso ou a massa dos metabólitos em termos com os quais o leitor estará familiarizado.
- Metz et al., “The Interaction of Dietary Vitamin A and Vitamin D Related to Skeletal Development in the Turkey Poult”, J. Nutr . 115 (1985) 929-935.
- ind, et al., “Subclinical hypervitaminosis A in rat: Measurements of bone mineral density (BMD) não revelam alterações esqueléticas adversas”, Chemico-Biological Interaction , 159 (2006) 73-80.
- Preço, em cit . p. 334.
- Blankenship, et al., “Mecahnisms of TCDD-associated anormalities and embryo lethality in white leghorn chickens,” Comparative Biochemistry and Physiology , Part C 136 (2003) 47-62.
- Masterjohn, Chris, “ Dioxins in Animal Foods: A Case for Vegetarianism ,” Publicado em 17 de outubro de 2005. Acessado em 21 de janeiro de 2006.
- Berson, et al., “Um ensaio randomizado de vitamina A e suplementação de vitamina E para retinite pigmentosa,” Arch Opthalmol , Vol. 111 No. 6 (1993) 761-72,
- Dommisse, John, “B12: Dificuldades e Obstáculos em Diagnóstico e Tratamento da Deficiência B12,” Wise Traditions 2005 , 12 de novembro de 2005.
- Masterjohn, Chris, “ Vitamin A: The Forgotten Bodybuilding Nutrient ,” publicado em 15 de dezembro de 2004. Acessado em 21 de janeiro de 2006.
- Fallon e Enig, “ Vitamin A Saga ,” publicado em 30 de março de 2002. Acessado em 21 de janeiro de 2006.
- Bastie, et al., “A ação cooperativa de 1a, 25-dihidroxivitamina D3 e ácido retinóico na diferenciação celular de leucemia promielocítica aguda NB4 é transcricionalmente controlada,” Experimental Cell Research , 310 (2005) 319-330.
- Greer, et al., “Os níveis de vitamina A em pacientes com FC são influenciados pela resposta inflamatória”, J Cyst Fibros Vol. 3 No. 3 (2004) 143-9.
- Russell, Robert M., “The vitamin A spectrum: from deficiency to toxicity,” Am J Clin Nutr , 71 (2000) 878-84.
- Tang, et al., “Conversão de curto prazo (intestinal) e de longo prazo (pós-intestinal) de ß-caroteno em retinol em adultos conforme avaliado por um método de referência de isótopo estável”, Am J Clin Nutr , 78 (2003) 259 -66.
- West et al., “Consequences of Revised Estimates of Carotenoid Bioefficacy for Dietary Control of Vitamin A Deficiency in Developing countries ,” J Nutr , 132 (2002) 290S-292S.
- Kardinaal, et al., “Relações entre Antioxidant Vitamisn in Adipose Tissue, Plasma, and Diet,” Am J Epidemiol 141 (1995) 440-50.
- De Pee, et al., “Quem tem uma alta ingestão de vitamina A de alimentos vegetais, mas uma baixa concentração de retinol sérico? Dados de mulheres na Indonésia, ” Eur J Clin Nutr , Vol. 53 No. 4 (1999) 288-97.
- Bulux, et al., “Plasma response of children to short-term cronico ß-carotene Supplementation,” Am J Clin Nutr , 59 (1994) 1369-75.
- Tang, et al., “Vegetais verdes e amarelos podem manter os estoques corporais de vitamina A em crianças chinesas”, Am J Clin Nutr , 70 (1999) 1069-76.
- Lewis et al., “Vitamin A turnover in rat as influenciado pelo estado da vitamina A”, J Nutr , Vol. 111 No. 7 (1981) 1135-44.
- Green et al., “Variação na taxa de utilização de retinol com o status de vitamina A no rato”, J Nutr Vol. 117 No. 4 (1987) 694-703.
- Rosenfeld, Louis, “Vitamina – vitamina. Os primeiros anos de descoberta ”, Clinical Chemistry , Vol. 43 No. 4 (1997) 680-685
- “Clássicos da nutrição. The American Journal of Hygiene, volume I, 1921: Estudos sobre raquitismo experimental. VII. A eficácia relativa do óleo de fígado de bacalhau em comparação com a gordura da manteiga para proteger o corpo contra cálcio insuficiente na presença de suprimento normal de fósforo. Por PG Shipley, EA Park, EV McCollum e Nina Simmonds. ” Nutr Rev , Vol. 42 No. 5 (1984) 192-4.
- Price, Weston A., op . Cit . p. 443.
- Razaitis, Lynn, “ The Liver Files: Recipes and Lore About Our Most Important Sacred Food ,” Publicado em 29 de julho de 2005. Acessado em 22 de janeiro de 2006.
- Sullivan, Krispin, “The Miracle of Vitamin D”, publicado em 31 de dezembro de 2000. Acessado em 22 de janeiro de 2006.
- Garden of Life, “Olde World Icelandic Cod Liver Oil: Lemon Mint Flavor,” http://www.gardenoflifeusa.com/detail_cod_liver_sup.shtml Acessado em 22 de janeiro de 2006.
- Green Pastures, “Cod Liver Oil,” http://www.greenpasture.org/cod_liver_oil.php Acessado em 22 de janeiro de 2006.
- Brustad, et al., “Vitamina D status em uma população rural do norte da Noruega com alto consumo de fígado de peixe,” Public Health Nutrition , Vol. 7 No. 6 (2004) 783-789.
- Nieves et al., At cit . p. 816.
- Voisin, Andre, Soil, Grass and Cancer , Austin: Acres USA (2000) Capítulo 8.
- Becker, Robert O. e Gary Selden, The Body Electric , Nova York: Morrow (1985) Capítulo 8.
- Zanello e Norman, “A modulação rápida das respostas do canal iônico de osteoblasto por 1a, 25 (OH) 2-Vitamina D3 requer a presença de um receptor nuclear de vitamina D funcional” , PNAS , Vol. 101 No. 6 (2004) 1589-1594.
- Menaa, et al., “1,25-Dihydroxyvitamin D3 Hypersensitivity of Osteoclast Precursors from Patients with Paget’s Disease,” Journal of Bone and Mineral Research , Vol. 15 No. 2 (2000) p. 228.
- Bastie, et al., “1a, 24-Dihydroxyvitamin D3 Transrepresses Retinoic Acid Transcriptional Activity via Vitamin D Receptor in Myeloid Cells,” Molecular Endocrinology , Vol. 18 No. 11 (2004) 2685-2699.